
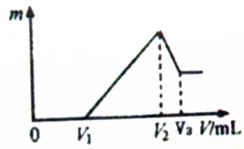
 将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:分析 由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,硫酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为硫酸钠溶液;
再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O,据此进行解答.
解答 解:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,硫酸有剩余,此时发生的反应为:H++OH-=H2O,则硫酸消耗的氢氧化钠溶液体积为V1mL;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,此时溶质为硫酸钠,总共消耗了(V2-V1)mL氢氧化钠溶液;
再继续滴加NaOH溶液至V3,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O,溶解氢氧化铝消耗的NaOH溶液体积为(V3-V2)mL,则铝离子生成氢氧化铝沉淀消耗氢氧化钠溶液体积为3(V3-V2)mL,则与Mg2+反应的NaOH溶液为:(V2-V1)mL-3(V3-V2)mL=(4V2-3V3-V1)mL
故答案为:V1;4V2-3V3-V1;
(2)根据分析可知,氢氧化钠溶液体积为V2时溶质为硫酸钠,则n(NaOH)=2n(H2SO4)=2mol/L×0.1L×2=0.4mol,
所以需要0.1mol/L的氢氧化钠溶液的体积为:$\frac{0.4mol}{0.1mol/L}$=4L=4000mL,
故答案为:4000mL.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线变化及对应反应原理为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3═NH4++HCO3- | B. | Ba(NO3)2═Ba2++2NO3- | ||
| C. | Ca(OH)2═Ca2++(OH)2- | D. | KAl(SO4)2═K++Al3++2SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾天车灯照射的光亮通路属于丁达尔现象 | |
| B. | 二氧化碳、氢氧化物和可吸入颗粒物等是雾霾的主要成分 | |
| C. | 寒冷的冬天,餐桌上的火锅冒出的热气是水蒸气 | |
| D. | 减少户外活动,戴上口罩等是有效应对雾霾天气的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若所得溶液呈中性,则生成的盐可能为强酸强碱盐 | |
| B. | 若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 | |
| C. | 若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 | |
| D. | 若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| 1 | 0.2 | 0.2 | >7 |
| 2 | a | 0.4 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com