
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | ||||||
| 3 | D | E | F | G | H | I | ||
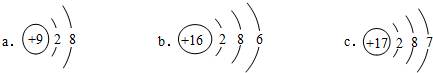
分析 由元素在周期表的位置可知,A为H,B为C,C为O,D为Na,E为Mg,F为Al,G为Si,H为S,I为Ar,
(1)稀有气体的性质最稳定;位于金属与非金属交界处的元素可作半导体材料;
(2)B为C,最外层电子数为4;
(3)同周期从左向右金属性减弱;
(4)元素位于元素周期表中第3周期第VIA族,可知原子结构中有3个电子层,最外层电子数为6;
(5)断裂化学键需要吸收能量.
解答 解:由元素在周期表的位置可知,A为H,B为C,C为O,D为Na,E为Mg,F为Al,G为Si,H为S,I为Ar,
(1)稀有气体的性质最稳定,则表中,最不活泼的元素是Ar;位于金属与非金属交界处的元素可作半导体材料,可用来制作半导体材料的物质的组成元素是Si,
故答案为:Ar;Si;
(2)B为C,最外层电子数为4,则最高正价为+4价,故答案为:+4;
(3)同周期从左向右金属性减弱,则D、E、F三种元素的金属性逐渐减弱,故答案为:减弱;
(4)元素位于元素周期表中第3周期第VIA族,可知原子结构中有3个电子层,最外层电子数为6,只有b符合,故答案为:b;
(5)断裂化学键需要吸收能量,则1mol H2O→2mol H+1 mol O的变化过程要吸收能量,故答案为:吸收.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置和性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
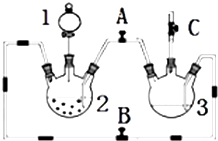 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
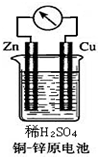 如图所示的铜-锌原电池中,
如图所示的铜-锌原电池中,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,LiMn2O4发生氧化反应 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 充电时,LiMn2O4发生氧化反应 | |
| D. | 充电时,阳极反应为:Li++e-═Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 部分卤代烃可用作灭火剂 | |
| B. | 甲醛的水溶液(福尔马林)可用于防腐 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 乙二醇可用于配制汽车防冻液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
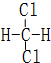 和
和 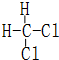 同一种物质.
同一种物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com