
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
【答案】C
【解析】
A.C3H8分子中每个C原子含有4个δ键,所以每个C原子价层电子对个数是4,则C原子采用sp3杂化,故A正确;
B.O2、N2都是以非极性键结合的双原子分子一定为非极性分子,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故B正确;
C.非金属性:C<P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,HClO不是氯元素的最高价氧化物对应的水化物,则酸性:H2CO3<H3PO4<H2SO4<HClO4,又H2CO3酸性大于HClO,则有酸性:HClO <H2CO3<H3PO4<H2SO4<HClO4,故C错误;
D.根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,如果是阳离子离子,原子序数之和减去所带电荷数值等于电子数,如:NO+它的电子式为![]() ,故D正确;
,故D正确;
综上所述,答案为C。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】暗红色固体X由三种常见的元素组成(式量为412),不溶于水,微热易分解,高温爆炸。
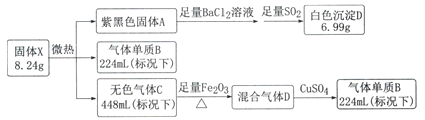
己知:气体B在标准状况下的密度为1.25g.L-1,混合气体通过CuSO4,CuSO4固体变为蓝色。
请回答以下问题:
(1)写出A的电子式____________。
(2)写出生成白色沉淀D的化学方程式________________________。
(3)固体X可由A与过量气体C的浓溶液反应生成,其离子方程式为_________________
(4)有人提出气体C在加热条件下与Fe2O3反应,经研究固体产物中不含+3价的铁元素,请设计实验方案检验固体产物中可能的成分(限用化学方法)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,正确的是( )
A.在晶体中只要有阳离子就一定有阴离子
B.离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键
C.分子晶体中分子间作用力越大,分子越稳定
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
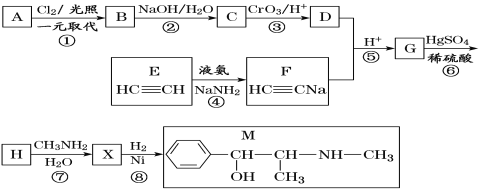
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
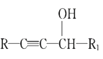
IV.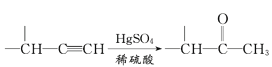
V.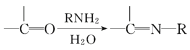
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)![]() H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2在一定条件下发生反应(纵坐标Y表示SO3的浓度)。下列说法正确的是
H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2在一定条件下发生反应(纵坐标Y表示SO3的浓度)。下列说法正确的是

A.T1>T2
B.平衡时,SO2的生成速率等于SO3的生成速率
C.当混合气体密度不变时,说明反应达到了平衡状态
D.当c(SO2):c(O2):c(SO3)=2:1:2时,说明反应达到了平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下三氯化氮( NCl3)是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法正确的是
A.分子中N—Cl键是非极性键
B.分子中不存在孤电子对
C.NCl3分子是极性分子
D.因N—Cl键的键能大,它的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出正丁烷的结构简式:___________;写出漂白粉有效成分的化学式:__________。
(2)写出镁条和氮气反应的化学方程式_____________________________________。写出铁和氯化铁溶液反应的离子方程式___________________________________。写出乙烯和水反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
2NH3(g) ΔH=-QkJ·mol-1,下列说法正确的是( )
A.达到平衡时反应放出的热量可能达到QkJ
B.升高温度,逆反应速率减小
C.当混合气体的密度不再发生变化时,说明反应达到平衡状态
D.达到平衡时,v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物分子式为C2H6O,该化合物的核磁共振氢图如图所示,请写出其结构简式___。

(2)有机物CH3-CH2-CH2-OH(1-丙醇),核磁共振氢谱共有___个特征峰,峰强度比为___。
(3)苯的同系物C9H12的核磁共振氢谱图,有2个特征峰,且峰面积之比为1:3,其结构简式___。
(4)已知:1,3-丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4-加成反应,生成环状化合物,这类反应称为双烯合成,例如:

在下列横线上写出适当的反应物或生成物的结构简式,完成下列反应的化学方程式:
①![]() +
+![]() →___
→___
②___+___→![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com