
| A、两种难溶物中溶解度小的物质其Ksp不一定小 |
| B、同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C、非金属性越强的元素其含氧酸酸性越强 |
| D、强电解质溶液的导电能力一定比弱电解质溶液导电能力强 |


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
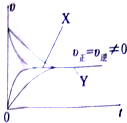 研究碳、氮、硫及其化合物的性质具有重要意义.
研究碳、氮、硫及其化合物的性质具有重要意义.| 活性炭 | NO | E | F | |
| 起始 | 2.500 | 0.500 | 0 | 0 |
| T1 | 2.350 | 0.200 | 0.150 | 0.150 |
| T2 | 2.400 | 0.300 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L稀硫酸100mL中含有SO42- 个数为0.1NA |
| B、1.7g NH3所含的电子数目为10NA |
| C、2g H2所含原子数目为2NA |
| D、标准状况下,33.6LSO3含有SO3分子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、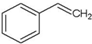 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 |
| B、乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 |
| C、气态烃CxHy与适量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则 y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含碳的质量分数越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:
X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com