
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
| ||
| △ |
| 1mol |
| 1mol+0.8832mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、食盐中阴离子的结构示意图为: |
| B、蔗糖和醋酸都是弱电解质 |
C、“84消毒液”中有效成分NaClO的电子式为: |
| D、明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,除去铜绿 |
| B、大量使用煤发电是形成雾霾的主要原因,天然气、煤气大量泄露遇到明火会爆炸 |
| C、利用化学反应可实现12C到14C的转化,高炉炼铁是炼铁最常用的方法 |
| D、青铜(铜锡合金)是一种复合材料,二氧化硅可以做光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
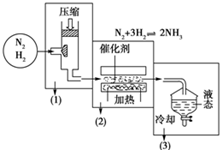 已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图:
已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图: 查看答案和解析>>
科目:高中化学 来源: 题型:
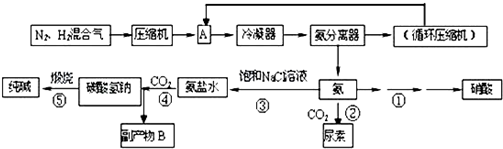
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
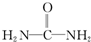 反应②的化学方程式是
反应②的化学方程式是
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
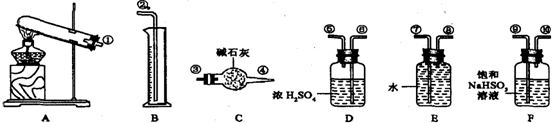
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
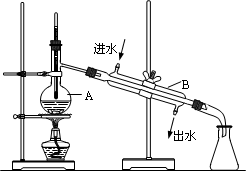 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com