
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
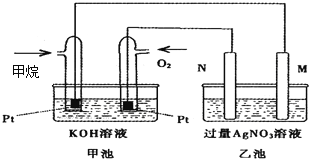
(1)M电极的材料是__________,其电极名称是_____________。
(2)N的电极反应式为____________________________,通入甲烷的电极反应式为______________________________________________,
(3)乙池总反应的化学方程式是_______________________________________________,
(4)在此过程中,乙池中某一电极析出金属银4.32g,甲池中理论上消耗氧气为_____mL(标准状况下),若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为__________.
【答案】 铁 阴极 ![]()
![]()
![]() 224mL 0.1mol·L-1
224mL 0.1mol·L-1
【解析】分析:甲池中两电极分别通入甲烷和氧气,属于甲烷燃料电池,因此乙池是电解池。甲烷在负极通入,氧气在正极通入,因此M电极是阴极,N电极是阳极,据此解答。
详解:(1)根据以上分析可知M是阴极,N是阳极,由于乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,所以M电极的材料是铁,其电极名称是阴极,溶液中的银离子放电。
(2)N是石墨,作阳极,溶液中的氢氧根离子放电,则电极反应式为4OH――4e-=O2↑+2H2O;甲池溶液显碱性,则通入甲烷的电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(3)根据以上分析可知乙池总反应的化学方程式是4AgNO3+2H2O![]() 4HNO3+4Ag+O2↑;
4HNO3+4Ag+O2↑;
(4)n(Ag)=4.32g÷108g/mol=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=1/4×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=2.24L=224mL;乙电池发生反应:4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,转移0.04mol电子,生成氢离子物质的量为0.04mol,若此时乙池溶液的体积为400 mL,则乙池中溶液的H+的浓度为0.04mol÷0.4L=0.1 mol·L-1。
4Ag+4HNO3+O2↑,转移0.04mol电子,生成氢离子物质的量为0.04mol,若此时乙池溶液的体积为400 mL,则乙池中溶液的H+的浓度为0.04mol÷0.4L=0.1 mol·L-1。


科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是
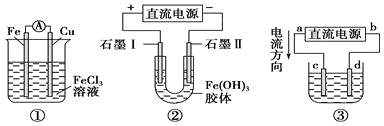
A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-═IO3-+5I-+3H2O下列说法不正确的是( )
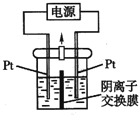
A. 右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式:![]()
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝等金属单质及其化合物在生产和生活中有着广泛的应用。
(1)金属冶炼与处理常涉及氧化还原反应,由下列物质冶炼相应金属单质时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述_______(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________________________________。
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时负极反应式为_____________。
(4)氨气也可作为燃料电池的燃料源制成高效率无污染的燃料电池系统,总反应式为:![]() (未配平),写出此碱性燃料电池的负极反应式:_______。
(未配平),写出此碱性燃料电池的负极反应式:_______。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_________________________。
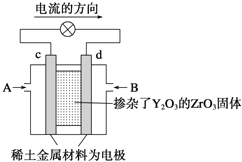
(6)科学家制造出一种使用固体电解质的燃料电池,其效率高无污染,多用于航天航空。如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-),d电极上的电极反应式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在唾液淀粉酶催化淀粉分解实验中,将唾液稀释10倍,与用唾液原液(没稀释)实验效果基本相同,这表明酶具有
A.专一性 B.稳定性
C.多样性 D.高效性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液(此时不考虑CO32-的水解),滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为w点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. 此温度下,Ksp(CaCO3)=1x10-8.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
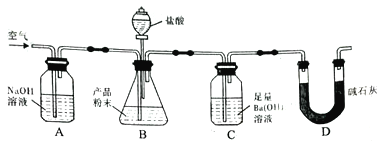
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 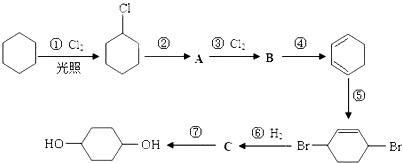
(1)写出反应④、⑦的化学方程式:④; ⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com