
_____________________________________________________________________
_____________________________________________________________________
科目:高中化学 来源: 题型:
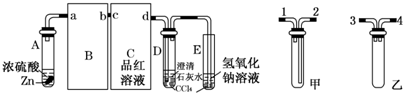
查看答案和解析>>
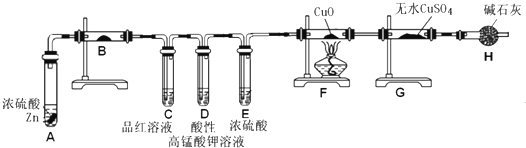
科目:高中化学 来源: 题型:
查看答案和解析>>
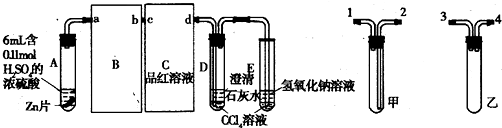
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2能使紫色石蕊试液褪色 |
| B | 浓硫酸具有强氧化性 | 将浓硫酸滴到用水润湿的蔗糖中,蔗糖变黑色海绵状 |
| C | 在一定条件下铁与水可以发生反应 | 将水蒸气通过灼热的铁粉,粉末变红 |
| D | 盐类水解都是吸热反应 | 向0.1mol?L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性 | B、浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性 | C、铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性 | D、常温下浓硫酸可以用铝罐储存,说明铝与冷的浓硫酸不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com