
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
分析 碳酸钙物质的量为$\frac{15.0g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,结合选项判断.
解答 解:碳酸钙物质的量为$\frac{15.0g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,
A.C3H4和 H2等物质的量混合,平均分子式为C1.5H3,不符合题意,故A错误;
B.C3H8和 CO等物质的量混合,平均分子式为C2H4,符合题意,故B正确;
C.CH4和 C3H4等物质的量混合,平均分子式为C2H4,符合题意,故C正确;
D.C3H6和 CO2等物质的量混合,平均分子式为C2H3O0.5,不符合题意,故D错误;
故选BC.
点评 本题考查有机物分子式确定的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
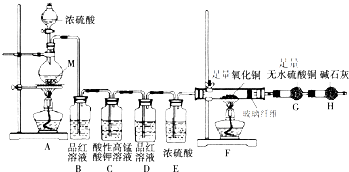
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 500 mL | C. | 250 mL | D. | 100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2的反应速率与NO的反应速率相等 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 单位时间内生成n molO2的同时生成2nmolNO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子序数等于核电荷数 | |
| B. | 元素原子的质子数等于核外电子数 | |
| C. | 元素所在周期序数等于该元素原子的最外层电子数 | |
| D. | 元素所在周期序数等于该元素原子的电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: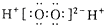 | |
| B. | 铝离子的结构示意图: | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com