
����Ŀ��ʵ����������������������Ҵ���Ũ�����Ʊ�1��2�����������װ������ͼ��ʾ�����п��ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѡ��й������б����£�

�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -l30 | 9 | -1l6 |
�ش��������⣺
��1��������������������Ҵ���Ũ�����Ʊ�1��2���������������������У��ڶ�����Ӧ�Ļ�ѧ����ʽΪ_______________
��2���ڴ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_______������ȷѡ��ǰ����ĸ����
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��3����װ��C��Ӧ����_______����Ŀ�������շ�Ӧ�п������ɵ��������壨����ȷѡ��ǰ����ĸ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��________�㣨��������������������
��5����������������δ��Ӧ��Br2�������__________ϴ�ӳ�ȥ����ѡ��ǰ��ĸ����
a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____________________
���𰸡�CH2=CH2+Br2��CH2BrCH2Br d c �� b ���� ������ȴ��ʹ�����̶�ʹ��·���ܣ�����
��������
��1��������������������Ҵ���Ũ�����Ʊ�1��2-�������������������У���Ӧԭ�����£���һ����ӦΪCH3CH2OH![]() CH2=CH2+H2O���ڶ�����ӦΪCH2=CH2+Br2��BrCH2CH2Br��
CH2=CH2+H2O���ڶ�����ӦΪCH2=CH2+Br2��BrCH2CH2Br��
��2���Ҵ���Ũ����140��������£�������������ˮ�������ѣ���Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ���ǣ����ٸ������������ɣ�ѡ��d��
�ʴ�Ϊ��d������
��3��Ũ�������ǿ�����ԣ����Ҵ������ɶ�����̼����������ԭ�ɶ�����������̼�����������ܺ�����������Һ��Ӧ�������գ���ѡc��
�ʴ�Ϊ��c��������
��4��1��2-���������ˮ�����ܣ�1��2-���������ܶȱ�ˮ���л������²㣬
�ʴ�Ϊ���£�����
��5��a���������1��2-�������飬��ˮ����ȥ�壬ѡ��a����
b��������Br2���������Ʒ�����Ӧ��2NaOH+Br2�TNaBr+NaBrO+H2O���ٷ�Һ��ȥ��ѡ��b��ȷ��
c��NaI���巴Ӧ���ɵ⣬�������1��2-�������飬���ܷ��룬ѡ��c����
d���ƾ���1��2-�������黥�ܣ����ܳ�ȥ���е��壬ѡ��d����
�ʴ�Ϊ��b����
��6��1��2-�������������ѵķе㲻ͬ�����߾�Ϊ�л�����ܣ�������ķ��������Ƿ��룬
�ʴ�Ϊ������
��7�����ڳ������ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ�����ȴ�ɱ�����Ĵ����ӷ�����1��2-������������̵�Ϊ9�棬�¶Ƚϵͣ����ܹ�����ȴ��������ȴ��ʹ�����̶�ʹ��·������B�г�������Һ��������
�ʴ�Ϊ����ȴ�ɱ�����Ĵ����ӷ���1��2-������������̵�ϵͣ�9�棩��������ȴ��ʹ�����̶�ʹ��·������


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���GΪ�߷��Ӳ��ϣ���һ�ֺϳ�·����ͼ��
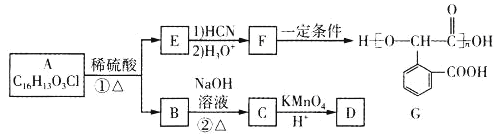
��֪����B�ķ���ʽΪC8H9OCl
��R-CHO![]() R-CH(OH)COOH
R-CH(OH)COOH
�ش��������⣺
��1��D�������������������ڣ�1molD������̼��������Һ��Ӧ������2molCO2��D��������_____����˴Ź���������____�����շ塣
��2���ڵķ�Ӧ������____��
��3��E�ĺ��������ŵ�����Ϊ_____��
��4���ٵĻ�ѧ����ʽΪ_____��
��5��X��E��ͬ���칹�壬X���б����ұ����ϵ�һ�ȴ�����2�֣��ܷ���������Ӧ�����Ȼ�����Һ����ɫ��д��3�ַ���Ҫ���X�Ľṹ��ʽ______��
��6�����������ϳ�·�ߣ������![]() Ϊԭ�Ϻϳ�G��·��(���Լ���ѡ)_____��
Ϊԭ�Ϻϳ�G��·��(���Լ���ѡ)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��ϵͳ����Ϊ2��2�һ�����
��ϵͳ����Ϊ2��2�һ�����
B.������KMnO4��Һ����ȷ��CH2=CHCHO�к���C=C˫��
C.�����������£�CH3CO18OC2H5��ˮ�������CH3COOH��C2H518OH
D.��ϩ�;�����ϩ����ʹ������Ȼ�̼��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е���Ҫ��Ⱦ��ΪNOx��CO���к����ʡ�Ŀǰ�����о����˶�����������β����Ⱦ�ķ�����
I.��������ʱ��H2��NO��ԭΪN2��
��֪��
��H2��ԭNO���ɵ�����ˮ�������Ȼ�ѧ����ʽ�ǣ�______________________________��
II.�û���̿��ԭ������������йط�ӦΪC(s)+2NO(g)![]() N2(g)+CO2(g)��H=QkJ/mol����2L�����ܱ����м���������C��NO��Ӧ������ʵ���������
N2(g)+CO2(g)��H=QkJ/mol����2L�����ܱ����м���������C��NO��Ӧ������ʵ���������
ʵ���� | �¶�/�� | ��ʼʱNO�����ʵ���/mol | ƽ��ʱN2�����ʵ���/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ________________________________________��
��2����ϱ������ݣ��жϸ÷�Ӧ��Q___0(����>������<��)��������________________________��.
��3���õ���ʽ��ʾ����CO2���γɹ���_________________________________________��
��4���жϸ÷�Ӧ�ﵽƽ���������____________
a.�������������ܶȺ㶨����Ӧ�ﵽƽ��״̬
b.�������ڸ�����Ũ�Ⱥ㶨����Ӧ�ﵽƽ��״̬
c.��������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
d.��2������NO��=���棨N2������Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���F�ĺϳ�·��ͼ��ͼ��
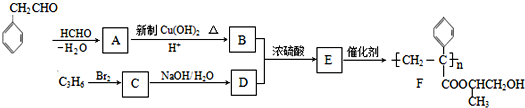
��֪��HCHO+RCH2CHO![]()
![]()
![]()
��ݴ˻ش�
��1��A�к���������������________________��C��ϵͳ����Ϊ_____________________ ��
��2������B���������������õ��Լ���______________��_____________��E��F�ķ�Ӧ������______________��B+D![]() E�ķ�Ӧ������______________________��
E�ķ�Ӧ������______________________��
��3��д��A��B�Ļ�ѧ����ʽ__________________________________________________��
��4��д��C��D�Ļ�ѧ����ʽ__________________________________________________��
��5�����������ϳ�·�ߣ����һ���ɼ�ȩ����ȩ�ͼ״�Ϊ��Ҫԭ���Ʊ�![]() �ĺϳ�·��_______________________________________________________________
�ĺϳ�·��_______________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к�����Ϊ�ḻ�ķǽ���Ԫ�أ����ĵ��ʺͻ������ڹ�ũҵ������Ӧ�ù㷺������ͨ����Ӧ 2Ca3(PO4)2+10C��6CaO+P4+10CO ��á����������գ�
��1����ԭ�ӵ����������Ų�ʽ��__________����ԭ�Ӻ�����______�ֲ�ͬ�˶�״̬�ĵ��ӡ�C��O����Ԫ�طǽ����Խ�ǿ����_______________��
��2�������ڿ�����¶��ʱ�䳤�˻����¶ȴﵽ____����ȼ��ʹ�������µ�������Ҫ����_________��ij�¶�ʱ����2.0L�����ܱ������г���0.5mol PCl5��������ӦPCl5(g)![]() PCl3(g)+Cl2(g)��Q������һ��ʱ���ﵽƽ�⡣
PCl3(g)+Cl2(g)��Q������һ��ʱ���ﵽƽ�⡣
��3���÷�Ӧ��ƽ�ⳣ������ʽ K=_____________��
��4�������������䣬��ʼʱ�����������г���1.0 mol PCl5���ﵽƽ��ʱ��PCl5��ת����____��ѡ������������ ����С��������������ƽ�ⳣ�� K____��ѡ������������ ����С��������������
��5���ڲ�ͬʱ�䣨t����÷�Ӧ������ PCl5 �IJ����������£�
t��s�� | 0 | 50 | 100 | 250 | 350 |
n��mol�� | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
�� 100s ʱ�� PCl3�����ʵ���Ũ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��̼Ԫ��ͬ�����XԪ��λ��Ԫ�����ڱ��еĵ�һ�������ڣ�������Ԫ��Yԭ�ӵ��������������ڲ����������3�������γɻ�����ķ���ʽ��XY4���Իش�
(1)XԪ�ص�ԭ�ӻ�̬ʱ�����Ų�ʽΪ��___________________________________��YԪ��ԭ���������ӵĵ����Ų�ͼΪ��____________��
(2)��X��Y��Ԫ�ص縺�Էֱ�Ϊ2.1��2.85�����ж�XY4��X��Y֮��Ļ�ѧ��Ϊ________(�������ۼ����������Ӽ���)��
(3)�û�����Ŀռ�ṹΪ______________�Σ�����ԭ�ӵĹ���ӻ�����Ϊ__________������Ϊ______________(�������Է����������Ǽ��Է�����)��
(4)�û������ڳ�����ΪҺ�壬��Һ���������������____________��
(5)�û�����ķе���SiCl4�Ƚϣ�________(�ѧʽ)�ĸߣ�ԭ����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ҽҩ��ҵ�����ںϳ�ͷ������������ƥĪ�ֵȵ��м��壬����·���Ǻϳɿ������ἰ���������һ�ַ�����

(1)��д��B�Ľṹ��ʽ_____��C�й����ŵ�����Ϊ_____��
(2)��Ӧ�ٵķ�Ӧ����Ϊ_____��D�ĺ˴Ź���������_____��塣
(3)1molE��������_____molNaOH��Ӧ����Ӧ�۵Ļ�ѧ����ʽΪ_____��
(4)����C���ӿ��Է�Ӧ���ɾ���������Ԫ���Ļ�����F����F�Ľṹ��ʽΪ_____��
(5)д����������������C��ͬ���칹��Ľṹ��ʽ_____��
A�����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
B����FeCl3������ɫ
C�������Ͼ�������λ�ڶ�λ��ȡ����
(6)��֪��RCH2COOH![]() RCHClCOOH�����Ա�����Ϊԭ�ϣ����Լ���ѡ������Ʊ����Ҵ��ᣨ
RCHClCOOH�����Ա�����Ϊԭ�ϣ����Լ���ѡ������Ʊ����Ҵ��ᣨ![]() ���ĺϳ�·��_____��
���ĺϳ�·��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С��ӷ����л��������ܣ�CoO�������������£�
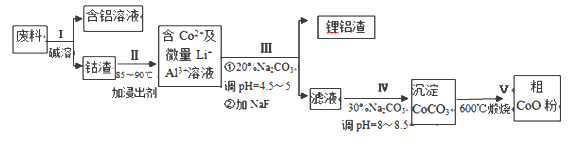
(1)���̢��в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ_________________��
(2)���̢��м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ�����ܡ�������ܵĻ�ѧ��Ӧ����ʽΪ ��������ֻ��һ�������_________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ���������ԭ�ͻ��������ĽǶȷ���������������ܵ���Ҫԭ��____��
(3)���̢�õ����������Ҫ�ɷ���LiF��Al(OH)3��̼������Һ�ڲ���Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ_____ ��
(4)��ͼ��CoCl2.6H2O�������ȷֽ�ʱ��ʣ�������������¶ȱ仯�����ߣ�B���ʵĻ�ѧʽ��______________ ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com