
 .
.分析 (1)①Y是黄绿色气体,则Y为氯气,若A、B的物质的量之比为1:4,则该反应为二氧化锰与浓盐酸的反应;
②若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气;
③氯气可与氢氧化钠溶液反应,氯气与水反应生成盐酸,盐酸与亚硫酸氢钠反应生成二氧化硫;
(2)A为金属单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,刺激性气体产物X应为二氧化硫.
解答 解:(1)①Y是黄绿色气体,则Y为氯气,若A、B的物质的量之比为1:4,则该反应为二氧化锰与浓盐酸的反应,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气,该反应的化学方程式,并用双线桥表示反应过程中的电子转移为 ,
,
故答案为: ;
;
③氯气可与氢氧化钠溶液反应,氯气可用氢氧化钠溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,氯气与水反应生成盐酸,反应的离子方程式为Cl2+H2O=Cl-+H++HClO,盐酸与亚硫酸氢钠反应生成二氧化硫,反应的离子方程式为H++HS03-=S02↑+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O、Cl2+H2O=Cl-+H++HClO、H++HS03-=S02↑+H2O;
(2)A为金属单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,则A能为铜、锌等,刺激性气体产物X应为二氧化硫,检验二氧化硫的方法为将气体通入品红溶液,能使溶液褪色,
故答案为:铜、锌;将气体通入品红溶液,能使溶液褪色.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及相互转化的特点,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | 在浓硫酸和稀硫酸中分别加入Cu片,加热 | 比较稀、浓硫酸氧化性强弱 |
| B | F2、Cl2分别与H2反应 | 比较氟、氯的非金属性强弱 |
| C | 把CO2通入到水玻璃中 | 比较碳、硅的非金属性强弱 |
| D | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中,FeS2是氧化剂,不是还原剂 | |
| B. | 在反应中,CuSO4是氧化剂,FeS2是还原剂 | |
| C. | 反应中Cu2+与FeS2的物质的量之比是14:5 | |
| D. | 反应中每生成1mol Cu2S共得2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
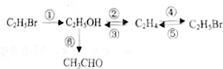
 ②CH3CH2OH
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O CH3CH2Br 乙醛的银镜反应
CH3CH2Br 乙醛的银镜反应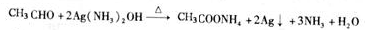
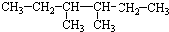 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com