
分析 (1)n (CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.05L×3mol/L=0.15mol,<1n(NaOH):n(CO2)=1.5<2,故反应生成Na2CO3、NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:$\left\{\begin{array}{l}{x+y=0.1}\\{2x+y=0.15}\end{array}\right.$,解得x=y=0.05,溶液中碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根水解程度大于碳酸氢根水解程度;
(2)已知:①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:3H2(g)+CO2(g)?CH3OH(g)+H2O(g),平衡常数为①、②平衡常数乘积;
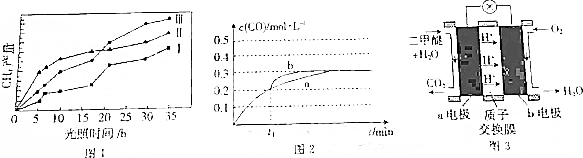
(3)相同时间内甲烷产量越大,说明反应速率越快,催化剂效果越好;
(4)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变条件不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L;
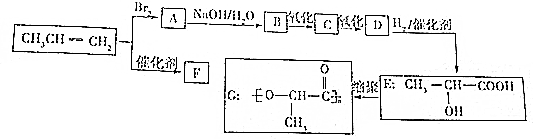
(5)由示意图可知,a电极中二甲醚发生氧化反应生成二氧化碳,则a为负极,b为正极.
解答 解:(1)n (CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.05L×3mol/L=0.15mol,<1n(NaOH):n(CO2)=1.5<2,故反应生成Na2CO3、NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:$\left\{\begin{array}{l}{x+y=0.1}\\{2x+y=0.15}\end{array}\right.$,解得x=y=0.05,溶液中碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根水解程度大于碳酸氢根水解程度,溶液中钠离子浓度最大,故离子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)已知:①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,800℃时该反应的化学平衡常数K的数值为2.5×1=2.5,
故答案为:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol;2.5;
(3)由图可知,0-15小时内,相同时间内第Ⅱ种催化剂的作用下收集的CH4最多,反应催化效果最好的催化剂是Ⅱ
故答案为:Ⅱ;
(4)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L,画出变化曲线为: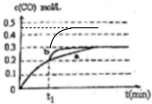 ,
,
故答案为:加入催化剂; ;
;
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+,
故答案为:正极;CH3OCH3+3H2O-12e-═2CO2+12H+.
点评 本题考查离子浓度大小比较、盖斯定律应用、平衡常数有关计算、化学平衡计算及影响因素、原电池等,题目涉及内容较多,基本属于拼合型题目,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1 CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL 0.01mol•L-1 H2SO4溶液与10mL 0.01mol•L-1 NaOH溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | 0.01mol/L Na2CO3溶液 | ||
| C. | pH=4NaHSO3溶液 | D. | pH=11氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汞 | B. | 氧化汞 | C. | 氧化铝 | D. | 硝酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乳酸的相对分子质量是72 | |
| B. | 乳酸的分子式是C2H6O3 | |
| C. | 1mol乳酸和适量的金属钠可放出氢气44.8L(标准状况) | |
| D. | 1mol乳酸和少量的碳酸氢钠溶液反应可放出二氧化碳22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.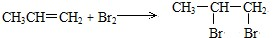 ,反应类型:加成反应;
,反应类型:加成反应;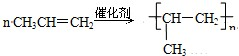 ,反应类型:加聚反应.
,反应类型:加聚反应.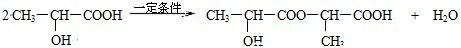 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| SiO2(CaCO3) | ||
| FeCl2(FeCl3) | ||
| FeCl3(FeCl2) | ||
| Fe2O3(Al2O3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com