
【题目】如图是制取干燥、纯净的氯气并验证氯气的性质的装置(加热及夹持装置省略)。

(1)写出装置A中制备氯气的化学反应方程式: 。
(2)装置C的作用是 。
(3)在反应过程中,装置D内干燥的蓝色石蕊试纸不变色,湿润的蓝色石蕊试纸先变红后退色,使试纸变红的物质是 (填化学式),使试纸退色的物质是 (填化学式)。
(4)装置D内湿润的KI淀粉试纸变蓝,说明Cl的非金属性 I的非金属性(填“大于”或“小于”)。
(5)该实验装置有个明显的缺陷是 。
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)干燥氯气
(3)HCl HClO
(4)大于
(5)缺少尾气吸收装置
【解析】
试题分析:分析图示装置知A为氯气的发生装置,装置B用于除去氯气中的氯化氢,装置C应用干燥氯气,装置D用于验证氯气的性质。
(1)装置A中二氧化锰和浓盐酸共热生成二氯化锰、氯气和水,化学反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)装置C的作用是干燥氯气。
(3)在反应过程中,装置D内干燥的蓝色石蕊试纸不变色,氯气与水反应生成盐酸和次氯酸,故湿润的蓝色石蕊试纸先变红后退色,使试纸变红的物质是HCl,使试纸退色的物质是HClO。
(4)装置D内湿润的KI淀粉试纸变蓝,说明Cl的非金属性大于I的非金属性。
(5)氯气有毒,应防止环境污染,该实验装置有个明显的缺陷是缺少尾气吸收装置。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】根据同分异构体的概念,判断下列物质互为同分异构体的是 ( )
A. CH3-CH2-CH3和 CH3-CH2-CH2-CH3 B. NO和CO
C. CH3-CH2OH和 CH3-O-CH3 D. 红磷和白磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是

A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.根据图②可判断可逆反应A2(g)+3B2(g) ![]() 2AB3(g)的△H<0
2AB3(g)的△H<0
C.图③可表示向Ba(OH)2溶液中加入Na2SO4溶液至过量时溶液导电性的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) △H>0未使用和使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌与盐酸制取氢气,其他条件不变,下列能使该反应速率增大的是( )
A. 降低温度 B. 用铁代替锌
C. 增大盐酸浓度 D. 用锌粒代替锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是
A.1.68gFe和足量水蒸气反应,转移的电子数目为0.09NA
B.由31H和168O组成的超重水11g,其中所含的中子数为6NA
C.1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA
D.1mol白磷(P4)分子中所含共价键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
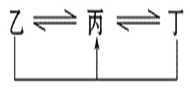
(1)单质B的结构式:_____ ____。
(2)A与C以1:1形成的化合物的电子式_ ____。
(3)F元素周期表中的位置:_____ _____。
(4)由A、C元素组成的氢化物庚和A、E元素组成的氢化物辛,热稳定性庚比辛_________(填“高”或“低”),理由是___ ____。
(5)B、C、E得电子后所形成的简单离子半径由小到大的顺序是____ _。(填具体离子符号)
(6)均含有F元素的乙与丁在溶液中发生反应的离子方程式____ _。均含有D元素的乙与丁在溶液中发生反应的离子方程式____ _
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、等杂质)中提取氧化铝的两种工艺流程如下:(提示:Na[Al(OH)4]+CO2(过量)═Al(OH)3↓+NaHCO3)

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式: ,固体A为(填名称) .
(2)验证滤液B含Fe3+,可取少量滤液并加入 .
(3)滤液B中加入过量烧碱发生的主要反应用离子方程式表示: .
(4)流程乙加入过量烧碱发生反应的化学方程式: .
(5)沉淀F的成分是(填化学式) .
(6)滤液E、K中溶质的主要成分是 (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此 时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)电解池阳极的电极反应分别是① ;②4OH--4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①已知负极的电极反应是CH4+4CO32-- 8e-=5CO2+2H2O。正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com