
| A、混合气体的平均摩尔质量不变 |
| B、当容器中气体压强不变 |
| C、生成2mol Z的同时生成1mol X |
| D、混合气体的密度不变 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、厨房发生煤气泄漏时,应立即打开换气扇,并打开门窗通风 |
| B、医学上常用95%的乙醇作为消毒剂 |
| C、保鲜膜、一次性食品袋的主要成分是聚乙烯 |
| D、人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.5mol?L-1min-1 |
| B、v(B)=1.2mol?L-1?s-1 |
| C、v(D)=0.3mol?L-1?min-1 |
| D、v(C)=0.1mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 试剂或操作 | 现象或结论 |
| A | 检验饼干中的淀粉 | KI溶液 | 饼干变蓝,含有淀粉 |
| B | 纤维素加硫酸水解后是否有葡萄糖 | 新制Cu(OH)2悬浊液加热 | 砖红色沉淀,有葡萄糖生成 |
| C | 鸡蛋清 | 浓硝酸 | 变黄色且有沉淀析出,发生了颜色反应并变性 |
| D | 油脂水解 | 加稀硫酸 | 油层消失,发生了皂化反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②⑤⑦ | B、②⑥⑦ |
| C、②④⑤⑥⑦ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
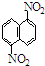 产品B:1,8-二硝基萘
产品B:1,8-二硝基萘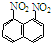 产品B可溶于质量分数大于98%的硫酸,产品A不能.利用这一可以将这两种异构体分离.下列说法正确的是( )
产品B可溶于质量分数大于98%的硫酸,产品A不能.利用这一可以将这两种异构体分离.下列说法正确的是( )| A、可以通过蒸馏的办法分离产品A和产品B |
| B、要获得产品A,将上述硝化产物加入适量的98.3%硫酸,通过萃取获得产品A |
| C、要获得产品B,将上述硝化产物加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤得滤液,向滤液中注水便有产品B析出 |
| D、是否生成两种二硝基物,可以取反应混和物,进行纸层析实验来检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
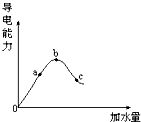 (1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:
(1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com