
| 实验编号 | 起始浓度 (mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | x | 0.05 | 7 |
| A. | HA是弱酸 | |
| B. | x>0.05 | |
| C. | 实验①所得溶液中:c(A-)+c(HA)=0.10mol/L | |
| D. | 实验②所得溶液中:c(Na+)=c(A-) |
分析 A.依据盐类水解的条件判断;
B.依据①可知,HA为弱酸,与氢氧化钠恰好反应生成强碱弱酸盐,常温下,要使溶液pH=7,则酸应剩余;
C.依据物料守恒解答,注意溶液等体积混合,溶液体积变为原来2倍;
D.依据电荷守恒解答.
解答 解:A.将两种浓度都是0.1mol/L的某一元酸HA分别与NaOH溶液等体积混合,得到溶液为NaA,常温下pH=9,可知溶液为强碱弱酸盐,所以HA为弱酸,故A正确;
B.依据①可知,HA为弱酸,与氢氧化钠恰好反应生成强碱弱酸盐,常温下,要使溶液pH=7,则酸应剩余,所以弱酸的浓度应大于弱碱,既x>0.05,故B正确;
C.①将两种浓度都是0.1mol/L的某一元酸HA分别与NaOH溶液等体积混合,得到溶液为NaA,依据物料守恒得:c(A-)+c(HA)=c(Na+)=0.05mol/L,故C错误;
D.溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),由②可知,常温下,反应后溶液pH=7,所以c(H+)=c(OH-),则c(Na+)=c(A-),故D正确;
故选:C.
点评 本题考查离子浓度大小比较、溶液PH值、盐类水解应用等,难度中等,判断一元酸HA是弱酸为解题关键,注意溶液中存在电荷守恒、物料守恒规律及应用.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:实验题
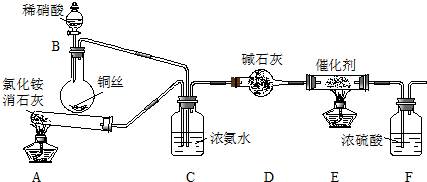
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大 | |
| B. | 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF) | |
| C. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| D. | AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(碳酸氢钠):加热,直到质量不再减少为止 | |
| B. | 溴苯(溴):加入氢氧化钠溶液洗涤,分液 | |
| C. | 乙醇(乙醛):加入新制氢氧化铜煮沸,过滤 | |
| D. | 乙酸丁酯(乙酸):加入碳酸钠溶液洗涤,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | Na2CO3是还原产物,O2是氧化产物 | |
| C. | 每转移4摩尔电子,有1摩尔氧气生成 | |
| D. | 1摩尔CO2参加反应就会产生11.2LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
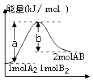
| A. | 该反应是放热反应 | |
| B. | 加入催化剂,(b-a)的差值减小 | |
| C. | 每生成2molAB分子吸收bkJ热量 | |
| D. | 若反应生成AB为液态,吸收的热量小于(a-b)kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com