
| A. | lmol Cu在适量硫蒸气中燃烧,得到的固体质量为80g | |
| B. | 分子数为NA的CO、C2H4的混合气体体积约为22.4L,质量为28g | |
| C. | 56g Fe投入足量冷的浓硝酸中,转移的电子数为3NA | |
| D. | 0.lmol1${\;}_{53}^{131}$I原子中含电子数为7.8NA |
分析 A.铜与硫蒸汽反应生成硫化亚铜;
B.气体状况未知;
C.浓硝酸具有强的氧化性,常温下能够使铁发生钝化;
D.1个${\;}_{53}^{131}$I原子中含有53个电子.
解答 解:A.铜与硫蒸汽反应生成硫化亚铜,lmol Cu在适量硫蒸气中燃烧生成0.5mol硫化亚铜,得到的固体质量为80g,故A正确;
B.气体状况未知,无法计算气体的体积,故B错误;
C.浓硝酸具有强的氧化性,常温下能够使铁发生钝化,所以56g Fe投入足量冷的浓硝酸中,转移的电子数小于3NA,故C错误;
D.0.lmol1${\;}_{53}^{131}$I原子中含电子数为5.3NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
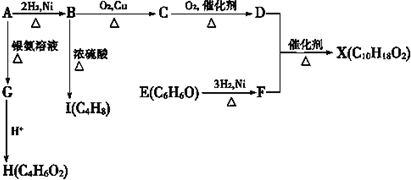
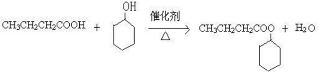 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).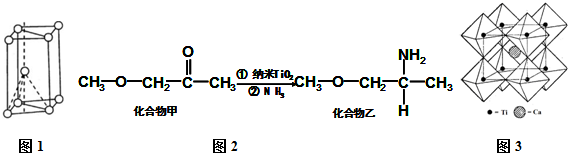
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与酸溶液反应,可用石英器皿盛放氢氟酸 | |
| B. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 | |
| C. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| D. | 将过量的CO2通入次氯酸钙溶液可生成次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
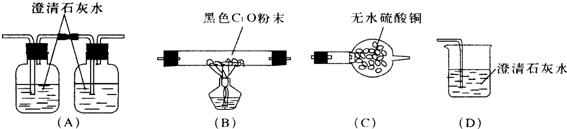
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
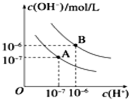 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离核越远 | |
| B. | 当M层是最外层时,最多可排布18个电子 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 核外电子的分层排布即是核外电子的分层运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com