
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市四校高三第一次联考化学试卷 题型:填空题
(8分)I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O[来源:学+科+网]
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
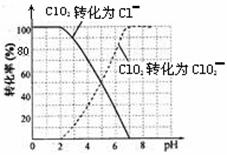
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差 ,工业上用湿法制备高铁酸钾的基本流程如下图所示:
,工业上用湿法制备高铁酸钾的基本流程如下图所示:
⑴在农业生产中,滤液1可用作 。
⑵流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是:  。
。
⑶结晶过程中加入浓KOH溶液的作用是: 。[来源:学_科_网]
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴ 在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵ 用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
 ①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4: 加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

⑴ 在农业生产中,滤液1可用作 。
⑵ 流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是: 。
⑶结晶过程中加入浓KOH溶液的作用是: 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。

查看答案和解析>>
科目:高中化学 来源:贵州省清华实验学校2010届高三下学期3月月考 题型:填空题
金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航
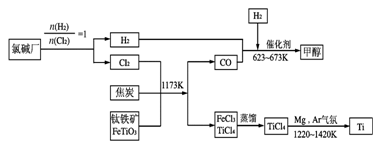 海、化工、医疗上不可缺少
海、化工、医疗上不可缺少
的材料。为了提高资源的利
用率,减少环境污染,可将
氯碱厂、炼钛厂和甲醇厂组
成产业链,其关系如下图所
示。请回答下列问题:
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式:_________________________________。
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l) △H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为 ,
该反应在氩气氛中进行的理由是 。
(4)在上述产业链中,合成96 t 甲醇理论上需额外补充H2 t (不考虑生
产过程中物质的任何损失)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com