
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
分析 A.AgNO3溶液过量;
B.强酸能制取弱酸;
C.水解时,阴离子总数不变;
D.越弱越水解.
解答 解:A.AgNO3溶液过量,不一定发生沉淀转化,应向氯化银沉淀加入碘化钾溶液,故A错误;
B.不反应说明酸性H2CO3>H3BO3,故B正确;
C.水解时,消耗一个阴离子产生一个氢氧根,阴离子总数不变,阴离子总数相等,故C错误;
D.H2A酸性强于H2B,Na2B水解程度大,B离子水解生成HB-和氢氧根,离子数增多,离子数目前者小于后者,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及沉淀转化、酸性比较以及盐类的水解等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |
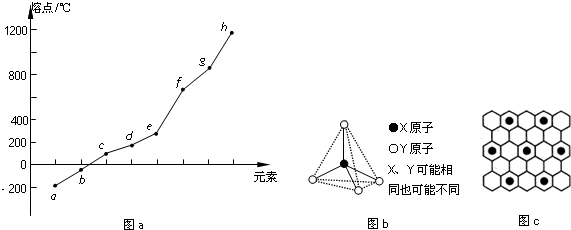
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
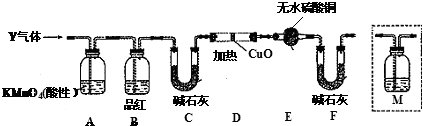
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| B. | 同一主族的两种元素的原子序数之差可能是44 | |
| C. | 卤素单质随原子序数的增大,其熔沸点逐渐降低 | |
| D. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
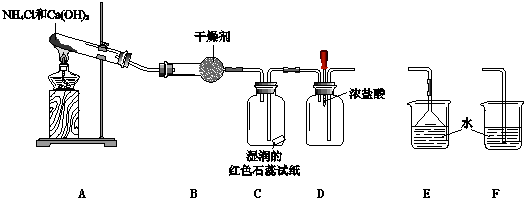
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com