
分析 W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成为CS2的化合物,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成WY的化合物,则W为Ca,化合物WY为CaS;④W和X能形成组成为CaC2的化合物,据此解答.
解答 解:W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成为CS2的化合物,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成WY的化合物,则W为Ca,化合物WY为CaS;④W和X能形成组成为CaC2的化合物.
(1)W元素的名称是钙,Z元素的名称是氧,故答案为:钙;氧;
(2)化合物WY和WX2以及XY2的化学式分别是CaS、CaC2、CS2,故答案为:CaS、CaC2、CS2;
(3)Y和Z形成的两种常见化合物的分子式是 SO2、SO3,实验室常用NaOH溶液洗涤被Y(硫)物质沾染的玻璃仪器,相应的化学反应方程式:3S+6NaOH═2Na2S+Na2SO3+3H2O,
故答案为:SO2;SO3;3S+6NaOH═2Na2S+Na2SO3+3H2O;
(4)在实验室常用CaO的水化物制备一种极易溶于水的气体,应是制备氨气,化学反应方程式:2NH4Cl+Ca(OH)2═CaC12+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2═CaC12+2H2O+2NH3↑.
点评 本题考查元素化合物的推断,难度中等,关键是正确推断元素,需要学生熟练掌握元素化合物知识.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.8mol/(L•s) | B. | v(N2)=0.4mol/(L•s) | ||
| C. | v(NH3)=0.6mol/(L•s) | D. | v(H2)=4.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
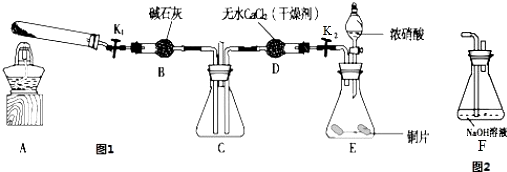
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 是地壳中含量最高的金属元素 |
| D | A、B、D组成的化合物X是84消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成黑色保护层:2Fe+3H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠溶液中加入氯化钙溶液产生沉淀 | |
| B. | 铜粉在空气中加热变成黑色粉末 | |
| C. | 石灰石溶于盐酸并产生无色无味的气体 | |
| D. | 液氢在空气中变为氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com