
在2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O反应中。
(1) 元素被氧化,氧化产物是 ; 还原产物是 ;氧化剂和还原剂的物质的量之比为
(2)用双线桥法表示该反应的电子转移情况。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________(填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置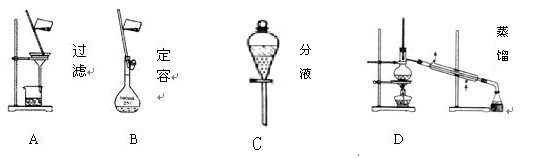
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国目前使用碘酸钾作为食用盐中碘强化剂。并规定,食用盐碘含量的平均水平(以碘元素计)为20 mg/kg ~ 30 mg/kg。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
反应中有1.5mol I2生成时转移电子数是 。
(2)已知:I2+2S2O32-=2 I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取20 .0g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目。
(2)又已知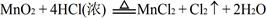 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。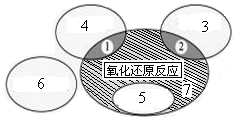
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
 N2+6NH4Cl
N2+6NH4Cl查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: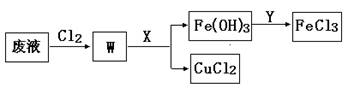
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·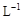 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com