
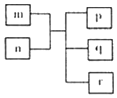
 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | 简单气态氢化物沸点Y>Z | |
| D. | X、Z、W三种元素可以形成离子化合物 |
分析 Y原子最外层电子数为次外层电子数的二倍,应为C元素,m为元素Y的单质,为C的单质,n为元素Z的最高价氧化物的水化物,为酸或碱,可与碳反应,短周期主族元素X、Y、Z、W原子序数依次递增,可知X为H、Y为C、Z为N、W为O元素,n为浓硝酸,p、q、r分别为NO2、CO2、H2O等,以此解答该题.
解答 解:由以上分析可知X为H、Y为C、Z为N、W为O元素,
A.同周期元素从左到右原子半径逐渐减小,应为C>N,故A错误;
B.非金属性O>N>C,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.N的非金属性较强,对应的氢化物含有氢键,沸点较高,故C错误;
D.H、N、O可形成硝酸铵,为离子化合物,故D正确.
故选D.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,题目难度中等,正确判断元素是解本题关键,结合物质的结构性质解答,注意熟练掌握原子结构与元素周期律、元素周期表的关系,本题易错点为n的判断,注意结合原子序数的关系排除浓硫酸的可能性.


科目:高中化学 来源: 题型:选择题
| A. | 植物油(水)与乙醇(水) | B. | 蛋白质溶液(NaCl)与淀粉溶液(KI) | ||
| C. | 泥水(淀粉溶液)与Fe(OH)3胶体(FeCl3) | D. | 氧化钙(碳酸钙)与NaHCO3 (Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuH与盐酸的反应属于置换反应 | |
| B. | CuH在Cl2中燃烧,1molCuH转移电子数为2NA | |
| C. | CuH在Cl2中燃烧时铜元素和氢元素均被氧化 | |
| D. | CuH与盐酸反应的离子方程式:H-+H+═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{49a}{b}$ mol-1 | B. | $\frac{49b}{a}$ mol-1 | C. | $\frac{98a}{b}$ mol-1 | D. | $\frac{98b}{a}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的摩尔质量为 282 | |
| C. | 56.4g青蒿素中所含氧原子数目为 6.02×1023个 | |
| D. | 青蒿素中 C、H、O元素的质量比为 15:22:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
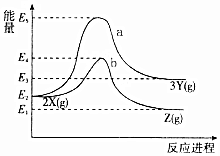
| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
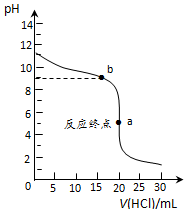
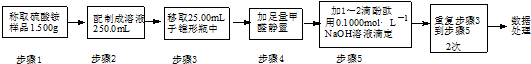
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com