
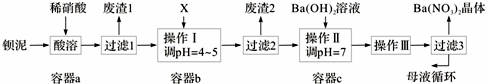
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化;
(2)Ba(FeO2)2与HNO3反应生成Ba(NO3)2和Fe(NO3)3,以此确定反应的化学方程式;
(3)X既要能消耗硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(4)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,可循环使用;
(5)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)溶液存在BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq),增大碳酸根离子的浓度,当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,使平衡正向移动从而除去BaSO4杂质,
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质;
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,由以上分析可知过滤后废渣2为Fe(OH)3,
故答案为:③;Fe(OH)3;
(4)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(5)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则 $\frac{261}{x}$=$\frac{233}{mg}$,解得x=$\frac{261m}{233}$,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
 ;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应:元素化合价是否变化 | |
| B. | 共价化合物:是否含有共价键 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 氧化物:含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题



 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;C 中所含官能团的名称是羧基和溴原子.
;C 中所含官能团的名称是羧基和溴原子. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com