
分析 (1)3molNO2反应放出138kJ热量,则△H=-138 kJ/mol;
(2)先写出反应的化学方程式并标明物质状态,然后根据放热反应焓变为负值写出反应的热化学方程式;
(3)根据热化学方程式的书写方法解答,化学计量数与反应热成正比,并注意标明物质的聚集状态,吸热反应中焓变为正值.
解答 解:(1)3molNO2反应放出138kJ热量,△H=-138 kJ/mol,则热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol,
答:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol;
(2)CO(g)还原1mol Fe2O3(s)放热24.8KJ,则反应的热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
答:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解生成液态汞和氧气时,吸热90.7kJ,标注物质聚集状态和对应焓变得到热化学方程式为:HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7 kJ/mol;
答:HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7 kJ/mol.
点评 本题主要考查了热化学方程式的书写,题目难度中等,注意掌握书写热化学方程式的方法:标注物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.


科目:高中化学 来源: 题型:选择题

| A. | 若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1.8倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n | |
| C. | 若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q | |
| D. | 加催化剂或增大压强,可实现如图a→b的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,写出它的一种用途做溶剂、灭火剂等.
,写出它的一种用途做溶剂、灭火剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用该实验的装置可以测定BaSO4的生成热 | |
| B. | 测定强酸强碱的中和热实验需要使用的玻璃仪器有:2 个500mL的烧杯、2个50mL的量筒、温度计 | |
| C. | 若将盐酸改用浓度和体积对应相同的CH3COOH进行实验,测得的△H将会减小 | |
| D. | 中和热测定实验中至少要测定3次温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
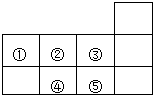
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 元素的最高正化合价:③=⑤ | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 标准状况下,2.24 LCCl4中含Cl原子数目大于0.4NA | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com