
下列说法正确的是( )
|
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 |
|
| B. | Na2CO3溶液中c(Na+)与c(CO32﹣)之比为2:1 |
|
| C. | 0.2 mol•L﹣1与0.1mol•L﹣1醋酸中c (H+)之比为2:1 |
|
| D. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
考点:
pH的简单计算;弱电解质在水溶液中的电离平衡;盐类水解的应用.
专题:
电离平衡与溶液的pH专题.
分析:
A.C(H+)=10﹣pH;
B.弱根离子在水溶液里能水解;
C.弱电解质溶液里,溶液越稀,弱电解质的电离程度越大;
D.若某物质的溶液pH<7,则该物质不一定是酸或强酸弱碱盐.
解答:
解:A.C(H+)=10﹣pH,所以pH=2与pH=1的硝酸中c(H+)之比=10﹣2:10﹣1=1:10,故A正确;
B.碳酸钠是强碱弱酸盐,碳酸根离子在水中能水解而钠离子不水解,导致溶液中c(Na+)与c(CO32﹣)之比大于2:1,故B错误;
C.醋酸是弱电解质,且溶液越稀,醋酸的电离程度越大,所以0.2 mol•L﹣1与0.1mol•L﹣1醋酸中c (H+)之比小于2:1,故C错误;
D.100℃时,纯水中C(H+)=C(OH﹣)=10﹣6 mol/L,溶液的pH=6,但溶液呈中性,故D错误;
故选A.
点评:
本题考查pH的简单计算,易错选项是D,注意溶液的酸碱性不能根据溶液的pH判断,要根据氢离子浓度和氢氧根离子浓度的相对大小判断,为易错点.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 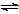 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为:2CH3OH+3O2+4OH- 2CO
2CO +6H2O,则有关说法正确的是 ( )
+6H2O,则有关说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH-—→CO +6H2O+6e-
+6H2O+6e-
C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
|
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在密闭容器中达到了平衡状态.平衡后c[CO2]=1.8mol•L﹣1,则该温度下此反应的平衡常数K为( )
|
| A. | 27 | B. | 36 | C. | 54 | D. | 81 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能量判据和熵判据的说法中,不正确的是( )
|
| A. | 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
|
| B. | 由能量判据和熵判据组合成的复合判据,将更适合于所有的过程 |
|
| C. | 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 |
|
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10﹣10 | 1.4×10﹣5 | 6.3×10﹣50 | 7.7×10﹣13 | 8.51×10﹣16 |
|
| A. | 五种物质在常温下溶解度最大的是Ag2SO4 |
|
| B. | 将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀 |
|
| C. | 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
|
| D. | 常温下,AgCl、AgBr和AgI三种物质的溶解度随着氯、溴、碘的顺序逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是()
A. 1mol甲烷的质量与甲烷的摩尔质量相等
B. 28g氮气与40g氩气所含的原子数目相等,都是NA个
C. 2.3g钠由原子变成离子,失去的电子数为0.1NA
D. 18g重水(D2O)所含的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com