
【题目】某化学课外小组用如图装置制取溴苯并证明苯和液溴发生的是取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
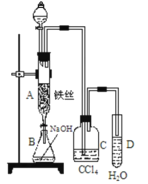
(1)写出 A 中发生反应的化学方程式_____________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________,写出有关反应的离子方程式____________。
(3)C中盛放 CCl4的作用是___________________。
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液, 若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___________,现象是_____________。
【答案】(1)![]()
(2)除去溶于溴苯中的溴;Br2+2OH—==Br—+BrO—+H2O或3Br2+6OH—→5Br—+BrO3—+3H2O;
(3)除去溴化氢气体中的溴蒸气;
(4)石蕊试液;溶液变红色 (其他合理答案都给分);
【解析】试题分析:(1)苯与溴在溴化铁作用下发生取代反应,反应方程式为:C6H6+Br2![]() C6H5Br+HBr;故答案为:C6H6+Br2
C6H5Br+HBr;故答案为:C6H6+Br2![]() C6H5Br+HBr;
C6H5Br+HBr;
(2)溴单质能与氢氧化钠溶液反应而溴苯不能,反应方程式:Br2+2NaOH═NaBr+NaBrO+H2O;故答案为:除去溶于溴苯中的溴,便于观察溴苯的颜色;Br2+2NaOH═NaBr+NaBrO+H2O;
(3)CCl4能溶解溴不能溶解溴化氢,四氯化碳能除去溴化氢气体中的溴蒸气,故答案为:除去溴化氢气体中的溴蒸气;
(4)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成,溴化氢与硝酸银反应生成溴化银淡黄色沉淀或在D中加入石蕊试液,若变红则发生取代反应,故答案为:石蕊试液;溶液变红色。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=1的溶液:Ag+、Al3+、Cl-、SO![]()
B.能使酚酞试液变红的溶液:Na+、K+、HCO![]() 、S2-
、S2-
C. ![]() =10-12的溶液:NH
=10-12的溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、Cl-
、Cl-
D.水电离产生的c(OH-)=10-12mol/L的溶液:K+、Fe2+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )B
A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且必须比水密度小
C.不溶于水,且必须比水密度大 D.不溶于水,且比水更容易使碘溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
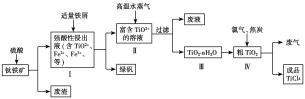
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 。
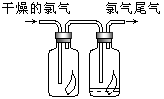
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)______________________________。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解 CuCl2溶液的装置,其中 c、d 为石墨电极。则下列有关的判断正确的是

A. a 为负极、b 为正极 B. a 为阳极、b 为阴极
C. 电解过程中,d 电极质量增加 D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体的是( )
A. AlCl3 B. MgSO4 C. (NH4)2CO3 D. NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com