
分析 (1)根据质量守恒定律计算参加反应氢气的质量,再根据原子守恒可知n(H2)=n(H2A)=n(A),计算A的相对原子质量,结合A的原子核中质子数和中子数相等确定原子序数;
(2)结合原子序数确定在周期表中位置,对于主族元素,周期数=电子层数,族序数=最外层电子数;
(3)根据确定的元素书写氢化物化学式,进而书写电子式.
解答 解:(1)根据质量守恒定律,参加反应的氢气的质量为3.4g-3.2g=0.2g,则n(H2)=$\frac{0.2g}{2g/mol}$=0.1mol,根据原子守恒,则n(H2)=n(H2A)=n(A)=0.1mol,则A的相对原子质量为$\frac{3.2}{0.1}$=32,A的原子核中质子数和中子数相等,所以A的原子序数为16,
答:A的原子序数为16;
(2)原子序数为16为硫,原子结构示意图为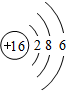 ,属于第三周期第ⅥA族,
,属于第三周期第ⅥA族,
答:元素A位于元素周期表中第三周期第ⅥA族;
(3)气态氢化物的化学式是H2S,属于共价化合物,分子中硫原子与H原子之间形成1对共用电子对,其电子式为: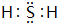 ,
,
答:气态氢化物的化学式是H2S,电子式为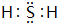 .
.
点评 本题考查元素推断、结构与位置关系、电子式等,属于计算型推断,题目难度不大,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ①④⑤⑦ | C. | ②③④⑥ | D. | ④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
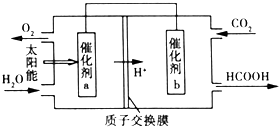
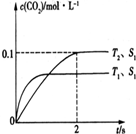 目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.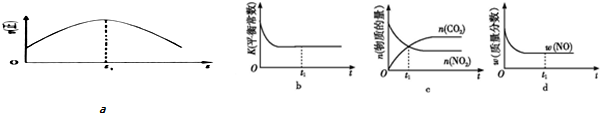
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(气体)+O2(气体)?2NO(气体) 正反应吸热 | |
| B. | NH4HCO3(固体)?NH3(气体)+H2O(气体)+CO2(气体) 正反应吸热 | |
| C. | 3O2(气体)?2O3(气体) 正反应吸热 | |
| D. | 2NO2(气体)?N2O4(气体) 正反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rb、K、Na、Li | B. | Cl、S、P、N | ||
| C. | Na+、Mg2+、Al3+、H+ | D. | I-、Br-、Cl-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
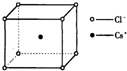 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )| A. | 2Ma3d | B. | M/(a3d) | C. | M/(2a3d) | D. | 2M/(a3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
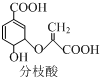 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com