
【题目】光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
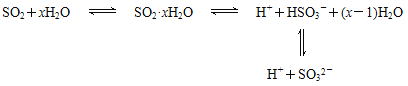
据此,下列判断中正确的是( )
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】将2.7g铝溶解于100mL 3 mol·L-1 NaOH溶液中,然后向所得溶液中加入400mL 1 mol·L-1盐酸,最后可得沉淀的质量是()
A.2.7gB.5.2gC.7.8gD.10g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25 ℃时,HClO2的电离平衡常数Ka=10-6
C. 25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液中(pH<7):c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____________;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=___________________;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。

以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则滤液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是______________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表

沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
开始沉淀pH (离子初始浓度0.01 mol/L) | 4.3 | 2.3 | 10.4 |
完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为_________。
(2)实验室进行步骤②的操作名称为________,其使用到的玻璃仪器是 。
(3)固体A的化学式为_______,物质C的化学式为_______;溶液中的Na+、Ca2+、Mg2+是在步骤________(填序号)中分离出去的。
(4)步骤③调节pH的数值范围为_______,步骤④调节pH的数值范围为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图所示。
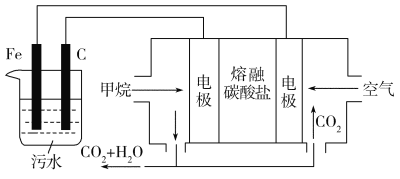
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e- = O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_______________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应式为__________________________________________;
②正极的电极反应式为__________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com