
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 次氯酸 | 干冰 |
| B | 冰 | 氨水 | 碳酸钙 | 氢氟酸 | 氨气 |
| C | 氯水 | 漂白粉 | 苛性钾 | 氢硫酸 | 氯化银 |
| D | 胆矾 | 福尔马林 | 氯化钡 | 碳酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物:有一种物质组成,包括单质和化合物;
混合物:由两种或两种以上的物质组成;
在水溶液里或熔融状态下完全电离的是强电解质,部分电离的是弱电解质;
在水溶液里或熔融状态下不导电的化合物是非电解质,电解质和非电解质都是化合物来分析.
解答 解:A、盐酸是HCl的水溶液,是混合物,不是纯净物,故A错误;
B、冰即固态的水,是纯净物;氨水是氨气的水溶液,是混合物;碳酸钙在溶于水后能完全电离,故为强电解质;HF在水溶液中只能部分电离,故为弱电解质;氨气在熔融状态下和水溶液中均不能导电,故为非电解质,故B正确;
C、氯水是氯气的水溶液,是混合物,不是纯净物;氯化银在熔融状态下能导电,故为电解质,故C错误;
B、氯气是单质,故既不是电解质也不是非电解质,故D错误.
故选B.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 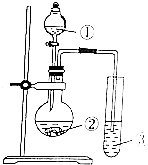 |
| A | 浓醋酸 | 石灰石 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 | |
| B | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| C | 稀硫酸 | FeS | SO2水溶液 | BaS可还原SO2 | |
| D | 盐浓酸 | 浓硫酸 | BaSO3悬浊液 | BaSO3可溶于盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol•L-1NaOH溶液480mL.
实验室需要0.1mol•L-1NaOH溶液480mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| B. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| C. | 标准状况下,18g水所含原子数为NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
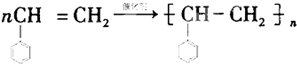 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
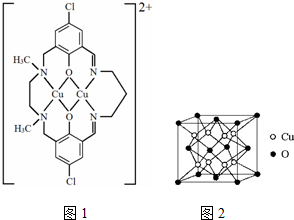
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com