
 .
. .
.分析 (1)有机物中氢元素的质量分数最大的是最简单的有机物甲烷;最简式相同等质量的物质完全燃烧耗氧量相同;
(2)含有碳碳双键或三键或苯环的烃能发生加成反应;
(3)甲烷在光照条件下能够与氯气发生取代反应,苯能够与液溴在催化剂作用下发生取代反应;
(4)含有碳碳双键的物质能发生加聚反应,氯乙烯加聚反应生成聚氯乙烯;
(5)二甲苯为苯环上有两甲基,两甲基处于邻间对位三种情况;根据对称的思想找等效氢一氯代物只有两种为对二甲苯;
(6)乙醇可催化氧化生成乙醛.
解答 解:(1)有机物中氢元素的质量分数最大的是最简单的有机物甲烷,⑧乙酸C2H4O2,最简式为CH2O,⑨葡萄糖C6H12O6,最简式为CH2O,它们的最简式相同,所以等质量的这两种物质完全燃烧耗氧量相同,
故答案为:CH4; C2H4O2和C6H12O6;
(2)含有碳碳双键或三键或苯环的烃能发生加成反应,所以③乙烯、④苯、⑤甲苯、⑥二甲苯能发生加成反应,
故答案为:③④⑤⑥;
(3)甲烷在光照条件下能够与氯气发生取代反应,如甲烷和氯气发生取代反应第一步反应生成一氯甲烷,方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,苯能够与液溴在催化剂铁作用下发生取代反应: ,
,
故答案为:光照; 催化剂;
(4)含有碳碳双键的有机物能发生加聚反应,氯乙烯含有碳碳双键能发生加聚反应,反应为 ,
,
故答案为: ;
;
(5)二甲苯为苯环上两个氢原子被甲基取代,两甲基处于邻间对位三种情况,分别为 、
、 、
、 ,分别用1、2、3标出三种二甲苯中苯环上的氢原子的位置有几种,它们的一氯取代物就有几种,甲基上的氢只有一种,
,分别用1、2、3标出三种二甲苯中苯环上的氢原子的位置有几种,它们的一氯取代物就有几种,甲基上的氢只有一种, 对邻间位三种情况它们的一氯取代物分别为1+1=2、2+1=3、3+1=4,“PX”,它的一氯代物只有两种,所以“PX”的结构简式是
对邻间位三种情况它们的一氯取代物分别为1+1=2、2+1=3、3+1=4,“PX”,它的一氯代物只有两种,所以“PX”的结构简式是 ,
,
故答案为:3; ;
;
(6)乙醇可催化氧化生成乙醛,方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握苯的同系物和同分异构体的书写、乙醇的催化原理等,掌握有机物的结构是解答的关键,注意(1)有机物中氢元素的质量分数最大的是最简单的有机物甲烷;最简式相同等质量的物质完全燃烧耗氧量相同,(5)注意根据对称的思想找等效氢,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4+C12$\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2=CH2+H2O→CH3-CH2OH | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$  +HBr +HBr | |
| D. | 2 CH3CH2OH+O2$→_{△}^{Cu}$ 2 CH3CHO+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(N2生成)=3υ(H2消耗) | |
| B. | H2、H2、HN3的分子数之比为1:3:2 | |
| C. | 单位时间内生成2molNH3,同时消耗1molH2 | |
| D. | 容器内的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

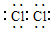 ,M的学化式为NaClO.
,M的学化式为NaClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com