
【题目】有机物A(C5H10O2)具有果香味,可用作食品加香剂,还可用作天然和合成树脂的溶剂。
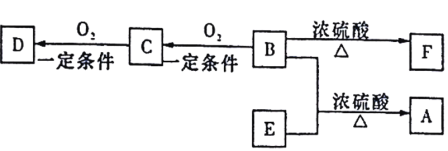
已知:①B、E分子中没有支链;
②D能与碳酸氢钠溶液反应放出二氧化碳;
③D、E具有相同官能团;E的相对分子质量比D大14;
④F是一种植物生长调节剂,能使溴的CCl4溶液褪色。
(1)B的化学名称为____________。D分子中所含的官能团的名称是____________。
(2)B与E生成A的反应类型是____________。
(3)写出F使溴的四氯化碳溶液褪色的化学反应方程式:________________________。
(4)A的结构简式为________________________。
【答案】乙醇 羧基 酯化反应(或取代反应) CH2=CH2+Br2→CH2BrCH2Br CH3CH2COOCH2CH3
【解析】
有机物A(C5H10O2)具有果香味,则A中含有的官能团为酯基。采用逆合成分析法可以看出,D能与碳酸氢钠溶液反应放出二氧化碳,可知D为酸,C为醛,B为醇;D、E具有相同官能团且E的相对分子质量比D大14,根据A的分子式及B、E分子中没有支链可知,E为丙酸,D为乙酸,故C为乙醛,B为乙醇,F是一种植物生长调节剂,能使溴的CCl4溶液褪色,则F为乙烯,A为CH3CH2COOCH2CH3,据此分析作答。
(1)B的化学名称为乙醇;D为乙酸,其分子中所含的官能团的名称是羧基;
(2)B与E生成A的过程为酸与醇发生酯化反应生成酯与水的过程,故其反应类型为:酯化反应(或取代反应);
(3)F为乙烯,其中含碳碳双键,与溴发生加成反应,其化学方程式为:CH2=CH2+Br2→CH2BrCH2Br;
(4)根据分析,A的结构简式为:CH3CH2COOCH2CH3。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
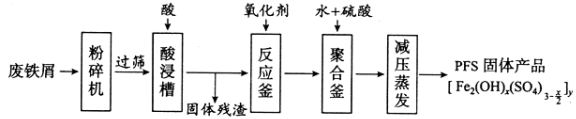
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___。
(2)写出天然橡胶单体(2—甲基—1,3—丁二烯)的结构简式___。
(3)立方烷![]() 的一氯代物有___种,它的六氯代物有___种。
的一氯代物有___种,它的六氯代物有___种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___。
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是____;互为同分异构体的是____;属于同种物质的是___。
①H2O和D2O②1H、2H、3H③乙烯和环丙烷(C3H6)④![]() 与
与![]() ⑤
⑤![]() 与
与![]() ⑥戊烯和环戊烷⑦
⑥戊烯和环戊烷⑦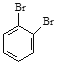 和
和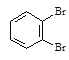
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。
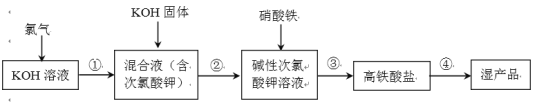
资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO![]() 2KCl+O2。
2KCl+O2。
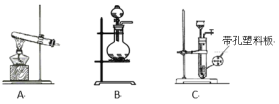
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________。
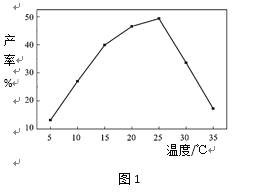
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。
(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
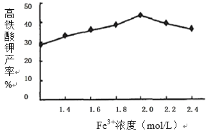
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水既不做氧化剂,又不做还原剂的是( )
A. Cl2+H2O=HCl+HClO B. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2F2+2H2O=4HF+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.常温常压下,22gCO2中所含二氧化碳分子数约为6.02×1023
B.0.1molL-1NaOH溶液中含有0.1molNa+
C.0.5molCl2中含有的氯原子数约为6.02×1023
D.标准状况下,44.8L水的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(部分生成物已略去)。其中,A为黑色固体;C、D为金属单质,且D为红色;H为红棕色粉末,常用作红色油漆和涂料。
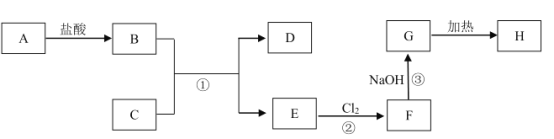
(1)写出物质H的化学式:___。
(2)写出下列反应的离子方程式:反应②___,反应③___。
(3)向E溶液中滴入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由白色变成红褐色的化学方程式:___。
(4)印刷电路板是由高分子材料和金属D复合而成的。刻制印刷电路时,要用过量的F溶液作为“腐蚀液”,其在刻制过程中作___(填“氧化”或“还原”)剂,写出该反应的离子方程式:___。
(5)某同学通过实验实现了反应F→E的转化,为了检验F是否完全转化为E,设计如下实验方案:取少量F于试管中,加水溶解,并滴加KSCN溶液,再向其中加入粉末C,振荡。当观察到___现象时,证明F完全转化为E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
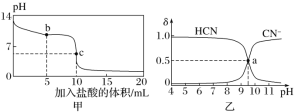
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究 FeCl3 溶液与 Na2SO3 溶液之间的反应,进行如下实验探究
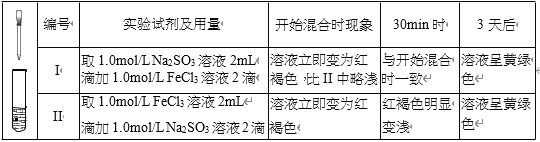
(1)配制 FeCl3 溶液时,先将 FeCl3 溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。

① 取少量 Na2SO3 溶液电极附近的混合液,加入______,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com