
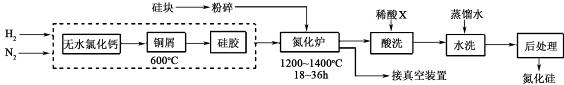
分析 (1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;
(2)①Cu能与氧气反应消耗氧气,硅胶具有吸水性,常用作干燥剂;
②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,反应物与生成物来书写化学反应方程式;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1.
解答 解:(1)四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,方程式为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
(2)①Cu能与氧气反应,消耗氧气,所以Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气;
故答案为:除去原料气中的氧气;除去生成的水蒸气;
②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=-727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽),
故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去;
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,
故答案为:硝酸;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1,补充HCl与H2的物质的量之比为≈5:1.
故答案为:5:1.
点评 本题考查了氮化硅的制备,设计方程式的书写、实验的评价等,明确工艺流程及物质的性质是解答本题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有② | C. | 只有②③④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. Fe+2ZG
Fe+2ZG查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4c-b+2a kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 分析 |
| A | Na+、Cu2+、SO42-、Cl- | 能大量共存于同一溶液中,通入过量NH3最终产生蓝色沉淀 |
| B | NH4+、Al3+、S2-、Cl- | 不能大量共存于同一溶液中,因为有Al2S3沉淀产生 |
| C | H+、Fe2+、SO42-、Cl- | 能大量共存于同一溶液中,加入KNO3固体后溶液颜色发生变化 |
| D | Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为HCO3-与OH-反应有CO2生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L的Na2CO3溶液中Na+个数为4NA | |
| B. | 2L 0.5mol/LCH3COOH溶液中含有的H+数为NA | |
| C. | 含2mol溶质的浓硫酸与足量的Cu反应转移的电子数为2NA | |
| D. | 1L 2mol/L的K2CO3溶液中CO32-个数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com