
分析 n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,故有机物A分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.4mol×2}{0.1mol}$=8,设有机物分子式为C3H8Ox,燃烧方程式为:C3H8Ox+(5-$\frac{x}{2}$)O2$\stackrel{点燃}{→}$3CO2+4H2O.
(1)根据消耗的氧气,可知x=0,故A为C3H8;
(2)根据消耗的氧气,可知x=1,故A为C3H8O,若A能催化氧化成醛,则分子中存在-CH2OH结构;
(3)1 mol该有机物含3 mol C、8 mol H,最多消耗O2 5 mol.
解答 解:n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,故有机物A分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.4mol×2}{0.1mol}$=8,设有机物分子式为C3H8Ox,燃烧方程式为:C3H8Ox+(5-$\frac{x}{2}$)O2$\stackrel{点燃}{→}$3CO2+4H2O.
(1)若燃烧消耗O2的物质的量为0.5mol,则5-$\frac{x}{2}$=5,可知x=0,故A为C3H8,结构简式为:CH3CH2CH3,
故答案为:CH3CH2CH3;
(2)若燃烧消耗O2的物质的量为0.45mol,则5-$\frac{x}{2}$=4.5,可知x=1,故A的分子式为C3H8O,若A能催化氧化成醛,则分子中存在-CH2OH结构,故A的结构简式为:CH3CH2CH2OH,
故答案为:C3H8O;CH3CH2CH2OH;
(3)由于1 mol该有机物含3 mol C、8 mol H,最多消耗O2 5 mol,故0.1mol A完全燃烧消耗O2的物质的量不可能大于0.5mol,
故答案为:不可能;1 mol该有机物含3 mol C、8 mol H,最多消耗O2 5 mol.
点评 本题考查有机物分子式确定的计算,注意利用组成通式进行解答,较好的考查学生分析计算能力,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应物是体积比1:3的乙醇和3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制反应温度 | |
| C. | 反应容器烧瓶中应加入少许瓷片 | |
| D. | 反应完毕先灭熄灭酒精灯,再从水槽中取出导管 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
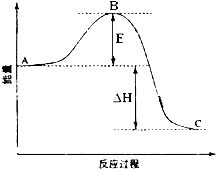 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com