
下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
【答案】C
【解析】A项Na与H2O的反应是固体液体反应生成气体,故该反应为熵增的反应,故△S>0,在反应中钠会熔化成一光亮的小球四处游动,发出咝咝声响,故该反应为放热反应,则△H<0,故△G=△H-T△S<0,故该反应能自发进行,A项正确;B项饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,Na2SO4为钠盐,故饱和Na2SO4溶液使蛋白质溶液产生沉淀是蛋白质的盐析,而浓硝酸为氧化性强酸,故使蛋白质溶液产生沉淀为蛋白质变性,二者原理不同,故B项正确;C项FeCl3和MnO2均可做H2O2分解的催化剂加快H2O2分解,同等条件下二者对H2O2分解催化效果不相同,故反应速率速率的改变不同,故C项错误;D项Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),NH4Cl溶液NH4+水解使溶液呈酸性,会消耗OH—,则Mg(OH)2(s)
Mg2+(aq)+2OH—(aq),NH4Cl溶液NH4+水解使溶液呈酸性,会消耗OH—,则Mg(OH)2(s) Mg2+(aq)+2OH—(aq)正向移动,故D、 Mg(OH)2固体可溶于NH4Cl溶液,故D项正确;本题选C。
Mg2+(aq)+2OH—(aq)正向移动,故D、 Mg(OH)2固体可溶于NH4Cl溶液,故D项正确;本题选C。
【考点定位】本题主要考查了化学 反应原理。涉及化学反应与能量的关系、化学反应速率的影响因素、化学平衡理论、蛋白质的性质判断等
反应原理。涉及化学反应与能量的关系、化学反应速率的影响因素、化学平衡理论、蛋白质的性质判断等
【名师点睛】本题考查化学反应与能量的关系、反应自发判断的依据、熵值、焓值变化的判断,蛋白质的盐析与变性、原理的分析,催化剂对反应速率的影响、同一化学反应催化剂可以不同的认识,化学平衡的移动的判断、沉淀的溶解平衡移动的判断,包含了选修4中的大部分的内容,对于反应原理的应用,应注重学生理解能力的培养,如化学反应中焓减、熵增为反应自发的判断依据,如何判断,勒夏特列原理对于任何可逆反应都适用,溶液中的平衡也不例外,催化作用与催化效果的不同,抓住反应的本质,使学生加以理解应用。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
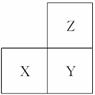 短周期元素X、Y、Z在周期表中的位置如图所示。下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示。下列说法正确的是( )
A.若它们均为金属元素,则X与氧元素组成的物质中一定只含离子键
B.若它们的原子最外层电子数之和为11,则它们均为非金属元素
C.它们的原子最外层电子数的大小顺序一定是Z=Y>X
D.Z元素的最高化合价不一定大于X元素
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下 图所示化合物的说法不正确的是( )
图所示化合物的说法不正确的是( )
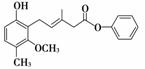
A.该化合物既可以催化加氢,又可以在光照下与Cl2发生取代反应
B.该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色
C.该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D.1 mol该化合物最多可以与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.CH3COOH与CH3COONa混合溶液中,一定有c(CH3COO-) >c(Na+)
B.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
C.AgCl在200ml 0.1mol/LNaCl中的溶解度小于在50ml 0.1mol/LMgCl2中溶解度
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在体积为2L的密闭容器中,加入1mol A与4mol B发生反应:
A(g)+ 2B(g) 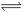 2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
| 温度℃ | 200 | 300 | 500 |
| α | 0.5 | 0.4 | 0.3 |
(1)Q 0(填< 、>、=)。
(2)在200℃时,若经5min达到平衡,则用物质C表示的平均速率为 。
(3)200℃时,将容器体积压缩为1L,平衡时的平衡常数K= 。
II.已知:
由常见的有机物A[CH2=C(CH3)2]可以实现如下的转化:
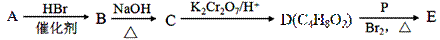
(1)A的系统命名为 ;B→C的反应类型是 。
(2)C的一种同类别的同分异构体M,M能发生催化氧化反应生成醛,则M 的结构简式为 。
(3)写出E与足量的氢氧化钠溶液共热反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
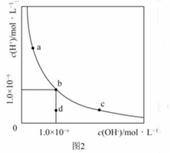 一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A.温度T下,该反应的平衡常数K=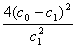
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CO(g)+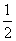 O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.76 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量分别为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com