
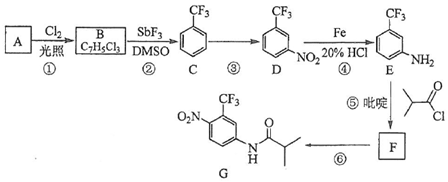
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.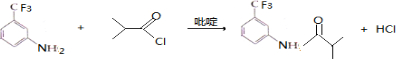 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.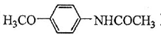 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(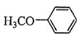 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选). 分析 由B的分子式可知A为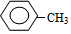 ,则B为
,则B为 ,C为三氟甲苯,发生硝化反应生成D,D还原生成E,生成F为
,C为三氟甲苯,发生硝化反应生成D,D还原生成E,生成F为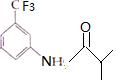 ,然后发生硝化反应生成G,结合对应的有机物的结构和性质解答(1)~(4);
,然后发生硝化反应生成G,结合对应的有机物的结构和性质解答(1)~(4);
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则苯环有3个不同 的取代基,对应的同分异构体的种类为${C}_{5}^{2}$种;
(6)由苯甲醚( )制备4-甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成
)制备4-甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成 ,发生还原反应生成
,发生还原反应生成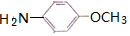 ,最后与CH3COCl发生取代反应可生成
,最后与CH3COCl发生取代反应可生成 ,以此解答该题.
,以此解答该题.
解答 解:(1)由以上分析可知A为甲苯,结构简式为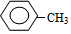 ,C的化学名称是三氟甲苯,故答案为:
,C的化学名称是三氟甲苯,故答案为: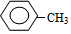 ;三氟甲苯;
;三氟甲苯;
(2)③为三氟甲苯的硝化反应,反应条件是在浓硫酸作用下,加热,与浓硝酸发生取代反应,
故答案为:浓硫酸、浓硝酸,并加热;取代反应;
(3)⑤的反应方程式为 ,反应中吡啶的作用是吸收反应产生的氯化氢,提高反应转化率,
,反应中吡啶的作用是吸收反应产生的氯化氢,提高反应转化率,
故答案为: ;吸收反应产生的氯化氢,提高反应转化率;
;吸收反应产生的氯化氢,提高反应转化率;
(4)由结构简式可知G的分子式为C11H11O3N2F3,故答案为:C11H11O3N2F3;
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则苯环有3个不同 的取代基,如固定一种取代基,则对应的同分异构体的种类为${C}_{5}^{2}$=10,或者说,固定-CF3和-NO2,如-CF3和-NO2处于邻位,另一种取代基有4种位置,-CF3和-NO2处于间位,另一种取代基有4种位置,-CF3和-NO2处于对位,另一种取代基有2种位置,共10种,则H可能的结构还有9种,
故答案为:9;
(6)由苯甲醚( )制备4-甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成
)制备4-甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成 ,发生还原反应生成
,发生还原反应生成 ,最后与CH3COCl发生取代反应可生成
,最后与CH3COCl发生取代反应可生成 ,则合成流程为
,则合成流程为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为2017云南考题,侧重考查学生的分析能力,注意把握题给信息,把握官能团的变化,对比有机物的结构简式,推断A为解答该题的突破口,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 目的 | 检验蔗糖与浓硫酸反应产物中有CO2 | 证明Fe(NO3)2溶液中存在Fe2+的水解平衡 | 检验某溶液中含有Ag+ | 比较非金属性:S>C>Si |
| 实验 操作 | 将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水 | 将稀硝酸滴入Fe(NO3)2溶液中 | 向待检液中滴加足量的稀盐酸 | 将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中 |
| 所用 装置 | 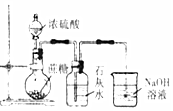 | 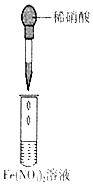 | 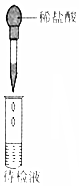 | 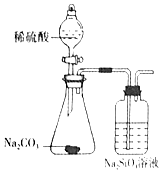 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若改为加入A物质可加快反应速率 | |
| B. | 达新平衡后B的转化率减小,A的转化率增大 | |
| C. | 达新平衡后A与B的转化率均增大 | |
| D. | 达新平衡后B的转化率不变,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
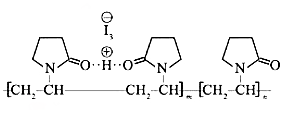 (图中虚线表示氢键)
(图中虚线表示氢键)| A. | 聚维酮的单体是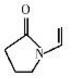 | |
| B. | 聚维酮分子由(m+n)个单体聚合而成 | |
| C. | 聚维酮碘是一种水溶性物质 | |
| D. | 聚维酮在一定条件下能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
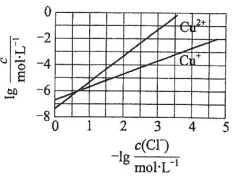 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“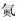 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
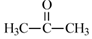 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com