
| A. | 氢气在氯气中燃烧产生苍白色火焰 | |
| B. | 铁丝在氯气中燃烧生成FeCl2 | |
| C. | 氯气的水溶液用于漂白,是利用氯气的强氧化性 | |
| D. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 |
分析 A.氢气在氯气中燃烧生成HCl;
B.红热的铁丝在氯气中燃烧,生成氯化铁;
C.氯气的水溶液用于漂白,是利用次氯酸的强氧化性;
D.NaOH具有强腐蚀性.
解答 解:A.氢气在氯气中燃烧生成HCl,火焰呈苍白色,反应为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故A正确;
B.氯气是强氧化剂,和变价金属反应生成高价金属的化合物,红热的铁丝在氯气中燃烧,生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故B错误;
C.氯气的水溶液用于漂白,是利用氯气和水反应生成的次氯酸的强氧化性,Cl2+H2O=HCl+HClO,氯气无漂白性,故C错误;
D.NaOH具有强腐蚀性,不能捂住鼻子,应用蘸有肥皂水货碳酸氢钠溶液的毛巾捂住鼻子,故D错误;
故选A.
点评 本题考查物质的性质及反应现象,为高频考点,把握发生的化学反应及产物与现象的关系为解答的关键,注意生成物的状态、颜色等,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3NA | |
| B. | 1mol苯酚中“C=C”的个数为3NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量氯化铵,c(H+)增大 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
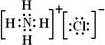 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
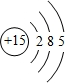 ,E的最高价含氧酸的化学式HClO4.
,E的最高价含氧酸的化学式HClO4.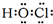 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com