
工业生产纯碱的工艺流程示意图如下:
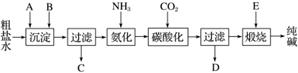
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A________,B________。
(2)实验室提纯粗盐的实验操作依次为取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______________________
________________________________________________________________________。
碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________
________________________________________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________(填写化学式),检验这一成分的阴离子的具体方法是:_____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水时所发生的反应的离子方程式为
________________________________________________________________________。
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.肢体中分散质粒于直径小于1×10-9m
B.区别胶体与溶液的最简单的方法是丁达尔效应
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线反射形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是__________________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有___________________________________________。
③Ⅳ的目的是__________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH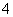 、Na+、Cl-、SO
、Na+、Cl-、SO
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
由第一电离能数据推断,最有可能生成稳定的单核阳离子的元素是( )
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. 氟 B.氯 C.溴 D.碘
查看答案和解析>>
科目:高中化学 来源: 题型:
| 审题指导 | |||||||||||||
| TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。 (1)实验室利用反应TiO2(s)+CCl4(g) 有关物质性质如下表:
仪器A的名称是________。装置E中的试剂是________。 反应开始前依次进行如下操作: 组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D 中的液态混合物,所采用操作的名称是________。 | 题干信息:反应条件是无水无氧,因而要先排空气,且要保 持反应装置内干燥。 装置图信息:A的作用是干燥氮气,B处产生CCl4(g),C为核心反应装置,D为冷凝装置,E为干燥装置,防止空气中的 水蒸气进入。 表格信息:根据CCl4和TiCl4的沸点可知在冰水中都会液 化,分离可用蒸馏。 问题信息:回答操作顺序,联系题干信息和装置特点知,N2必须进行干燥处理(干燥管);然后通过N2排除系统内的空气(O2),点燃酒精灯,使反应发生;为了防止倒吸,反应结束后,应先熄灭酒精灯。 | ||||||||||||
| (2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2 的有关反应包括: 酸溶 FeTiO3(s)+2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+ 2H2O(l) 水解 TiOSO4(aq)+2H2O(l) 简要工艺流程如下:
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度 过高会导致产品TiO2回收率降低,原因是________________________________________________________________________________________________________________________________________________。 ②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是______________(填化学式)。 | |||||||||||||
| 题干信息:Fe2O3杂质可溶于硫酸;FeTiO3酸溶后的产物TiOSO4易水解。 流程图信息:试剂A的作用是将溶液中的Fe3+转化为Fe2+ 问题信息:①解释TiO2的回收率,联系题干信息,从水解的视角。 ②Fe2+的检验方法;含Fe2+的溶液蒸干后变为Fe2O3。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置
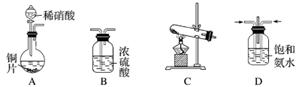

Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:__________________________(填字母)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是________________________________________________________________________。
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
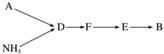
(4)A中反应的离子方程式为_______________________________________________
________________________________________________________________________。
(5)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是________________________________________________________________________。
(6)D装置中的液体可换成________(填字母)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(7)该同学所设计的模拟尾气处理实验还存在的明显缺陷是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1
D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O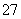 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
 测得实验①和②溶液中的Cr2O
测得实验①和②溶液中的Cr2O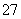 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O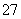 的浓度可用仪器测定]
的浓度可用仪器测定]
| 实验方案 | |
| (不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com