
| A、增大压强 | B、减小压强 |
| C、减少E的浓度 | D、降温 |


科目:高中化学 来源: 题型:
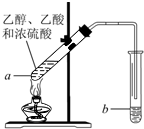 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,查看答案和解析>>
科目:高中化学 来源: 题型:
 现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )| A、1:3 | B、2:3 |
| C、6:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.44 L |
| B、6.72 L |
| C、2.8 L |
| D、5.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制造电缆 |
| B、制防锈油漆 |
| C、制饮料罐 |
| D、炼铝厂制造铝锭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提高溶液碱性 | B、提高溶液酸性 |
| C、加水 | D、升温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com