
 ,
, .
.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
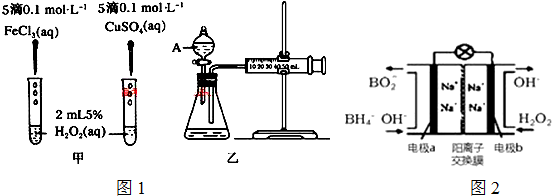
查看答案和解析>>
科目:高中化学 来源: 题型:
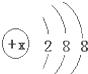 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中:查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 化合物,但不是电解质 | |
| (5) | 不是电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C、pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D、若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ⅣA族元素的简单氢化物CH4、SiH4、GeH4、SnH4的沸点随相对分子质量增大而升高,可推知VA族元素氢化物的沸点也具有完全同样的变化规律 |
| B、加热Ca(HCO3)2水溶液,低温蒸发至干,最终产物为CaCO3,从而有Mg(HCO3)2水溶液加热蒸发结晶后的最终产物为MgCO3 |
| C、CO2通入CaCl2溶液中无沉淀生成,因此SO2通入BaCl2溶液中也没有沉淀生成 |
| D、AlCl3溶液中加入Na2S的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑,可知FeCl3溶液中加入Na2S的离子方程式为:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com