
下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.CaCO3(s)+2HCl(l)===CaCl2(aq)+CO2(g)+H2O(l)
C.C(s)+O2(g)===CO2(g)
D.3O2(g)===2O3(g)
科目:高中化学 来源: 题型:
苯环结构中不存在碳碳单键和双键简单交替结构,可以作为证据的事实是:①苯不能使酸性高锰酸钾溶液褪色 ②苯环中的碳碳键均相同 ③经实验测得邻二甲苯仅有一种结构 ④苯不因化学反应而使溴水褪色( )
A.②③④ B.①③④
C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
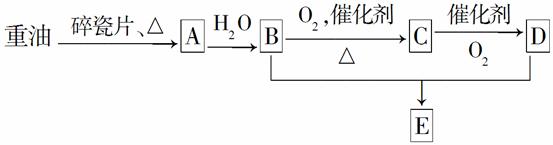
(1)工业上,由石油获得重油的方法是________,由重油获得A是________变化(填“物理”或“化学”)。A的名称为________。
(2)A—→B的反应类型是________;E的结构简式为________;写出C—→D的化学方程式:____________________________________。
(3)丁烷是由重油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:________________________________________,________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是
( )。

A.铁棒作负极,铜棒作正极,电解质溶液是CuSO4溶液
B.镁棒作负极,铁棒作正极,电解质溶液是CuSO4溶液
C.镁棒作负极,铁棒作正极,电解质溶液是FeCl3溶液
D.铁棒作负极,铜棒作正极,电解质溶液是H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
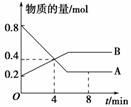
(1)该反应的化学方程式为__________________________________________________________________
________________________________________________________________。
(2)反应开始至4 min时,A的平均反应速率为_________________________________________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A+3B2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L-1·min-1
B.1 mol·L-1·min-1
C.2 mol·L-1·min-1
D.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:

如图,有一处于平衡状态的反应:
X(s)+3Y(g)2Z(g),为了使平衡向生成Z的方向移动,应选择条件是_______________________________________。
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,有一处于平衡状态的反应:
X(s)+3Y(g)2Z(g),为了使平衡向生成Z的方向移动,应选择条件是_______________________________________。
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法不正确的是________(填字母序号)。
A.液氨、液氯、液态氯化氢都是非电解质
B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
C.生物质能、沼气和乙醇都是可再生能源
D.铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
E.只有100 mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100 mL pH=2的盐酸
F.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
(2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。
①1887年阿仑尼乌斯提出电离理论。
②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子的水溶液既可看作酸又可看作碱的是________(填字母序号)。
A.CH3COO- B.H2O C.OH- D.HCO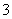 E.Cl- F.NH
E.Cl- F.NH
③1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。试指出下列两个反应中的酸或碱:
H3BO3+H2O===H++[B(OH)4]-
该反应中的碱是________(填“H3BO3”或“H2O”);
CuCl2+4NH3===[Cu(NH3)4]2++2Cl-
该反应中的酸是________(填“CuCl2”或“NH3”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com