
已知:C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1。
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O∶nC2H4=1∶1)。
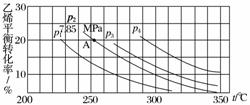
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________________________________________________________________________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是________________________________________________________________________
________________________________________________________________________。
③气相直接水合法常用的工艺条件为磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,nH2O∶nC2H4=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有________________________、________________________。
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.因为Na2CO3+SiO2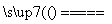 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸的强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸的强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅既能溶于氢氧化钠溶液又能溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。
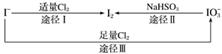
下列说法中不正确的是( )
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸不会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO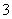
D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)Y(g)+Z(s) (乙)A(s)+2B(g)C(g)+D(g),当下列物理量不再发生变化时
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
其中能表明(甲)达到化学平衡状态是________;
能表明(乙)达到化学平衡状态是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=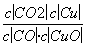
B.反应③的平衡常数K=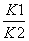
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的逐级电离能(kJ·mol-1)分别为740、1 500、7 700、10 500、13 600、18 000、21 700,当它与氯反应时最可能生成的阳离子是( )
A.X+ B.X2+
C.X3+ D.X4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com