
【题目】含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____;基态Cu+的核外电子排布式为_____。
(2)化合物(CH3)3N分子中N原子杂化方式为_____,该物质能溶于水的原因是_____。
(3)PH3分子的键角小于NH3分子的原因是_____;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
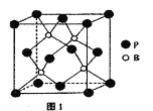
①在一个晶胞中磷原子的配位数为_____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为_____。
【答案】哑铃形 [Ar]3d10 sp3 (CH3)3N为极性分子,且可与水分子间形成氢键
(CH3)3N为极性分子,且可与水分子间形成氢键 电负性N>P,成键电子对离中心原子越近,成键电子对之间的排斥力越大,键角变大 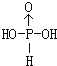 4
4 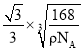
【解析】
(1)s能级电子云形状为球形、p能级电子电子云形状为哑铃形;Cu失去4s能级电子生成Cu+,根据构造原理书写该离子核外电子排布式;
(2)化合物(CH3)3N分子中N和每个C原子形成一个共价键,且还含有一个孤电子对,所以N原子价层电子对个数为4,根据价层电子对互斥理论判断N原子杂化方式;极性分子的溶质易溶于极性分子的溶剂,能和水形成氢键的溶质易溶于水;
(3)电负性N>P,键合电子对偏向N,成键电子对间斥力增大;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,说明为二元酸,则该分子中含有2个羟基,一个H原子和P原子形成共价键;
(4)①在一个晶胞中磷原子的配位数为4;
②该晶胞中P原子个数=8×![]() +6×
+6×![]() =4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=
=4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=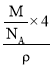 =
=![]() ,其棱长=
,其棱长=![]() ,B-P键长为体对角线的
,B-P键长为体对角线的![]() 。
。
(1)s能级电子云形状为球形、p能级电子电子云形状为哑铃形,基态B原子电子占据最高能级的电子为2p电子,其电子云轮廓图为哑铃形;Cu失去4s能级电子生成Cu+,根据构造原理书写该离子核外电子排布式为[Ar]3d10;
(2)化合物(CH3)3N分子中N和每个C原子形成一个共价键,且还含有一个孤电子对,所以N原子价层电子对个数为4,根据价层电子对互斥理论判断N原子杂化方式为sp3;极性分子的溶质易溶于极性分子的溶剂,能和水形成氢键的溶质易溶于水,(CH3)3N为极性分子,且可与水分子间形成氢键;
(3)电负性N>P,键合电子对偏向N,成键电子对间斥力增大,键角增大;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,说明为二元酸,则该分子中含有2个羟基,一个H原子和P原子形成共价键,其结构式为 ;
;
(4)①在一个晶胞中磷原子的配位数为4;
②该晶胞中P原子个数=8×![]() +6×
+6×![]() =4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=
=4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=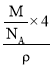 =
=![]() ,其棱长=
,其棱长=![]() ,,B-P键长为体对角线的
,,B-P键长为体对角线的![]() =
=![]() ×
×![]() ×
×![]() cm=
cm=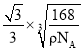 cm。
cm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题;

(1)④表示的元素是___(填元素符号);
(2)②、③两种元素相比较,原子半径较大的是___(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式___;
(4)③和⑤两种元素的非金属性强弱顺序是③____⑤(填“<”或“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:

已知:M的结构简式为: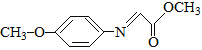 。
。
请回答下列问题:
(1)A的化学名称是_______________,B的化学式是________________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:______________________________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
① 能够发生银镜反应。
② 含有硝基(–NO2),且硝基直接连在苯环上。
③ 含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
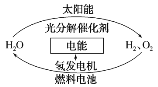
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2),又称碳酰氯,常温下为无色气体,剧毒。化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气2CHCl3+O2→2HCl+2COCl2。下列说法正确的是( )
A.CHCl3的立体构型为正四面体
B.COCl2为平面型分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.CHCl3是手性分子,存在手性异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境有着密切的关系。
(1)光导纤维的主要成分是_________(填化学式)
(2)工业上制造水泥、玻璃和高炉炼铁都要用到的原料是________(填字母)
A.纯碱 B.石英 C.黏土 D.石灰石
(3)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合使用时必须严格加以控制的是________(填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔 D.制防锈油漆
(4)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出氧化膜与氢氧化钠溶液反应的化学方程式:_____________________
(5)工业上从海水中提取溴单质,可向海水中通入Cl2,将其中的溴化物氧化,离子方程式为____________________
(6)如图为实验室中盐酸试剂瓶标签上的部分内容。试回答下列问题:

①该盐酸的c(HCl)为_________ mol/L
②欲用该盐酸配制1.19 mol/L的盐酸480 mL。完成下列有关操作中的空白。
a.用_________(填实验仪器名称)准确量取盐酸,注入烧杯中,加入适量的水,混合均匀;
b.将操作a所得的盐酸沿玻璃棒注入_________mL容量瓶中;
c.用适量的水洗涤烧杯、玻璃棒2~3次,洗涤液均注入容量瓶中,振荡;
d.缓缓地将蒸馏水注入容量瓶中,直到瓶中的液面接近容量瓶的刻度线l~2cm处,改用_______________加蒸馏水至溶液的凹液面正好与刻度线相切;
e.将容量瓶盖好,反复上下颠倒摇匀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
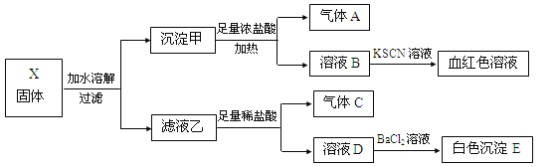
根据上述实验,下列说法正确的是
A.固体X中一定含有Fe2O3
B.沉淀E可能含有BaSO3
C.气体A、C一定均为纯净物
D.固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com