
 甲醇合成反应及其能量变化如图所示:
甲醇合成反应及其能量变化如图所示:| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
| 0.4mol/L |
| 10min |
| C(CH3OH) |
| C(CO)?C2(H2) |
| 0.8mol/L |
| 0.2mol/L?(0.4mol/L)2 |
| (1.6-0.5x)+(2.0-x)+0.5x |
| 1.6+2 |
| 1 |
| 2 |
| 1.8 |
| 2.0 |


科目:高中化学 来源: 题型:
| A、粒子半径:Al3+>Mg2+>Na+>F- |
| B、稳定性:HI<HBr<HCl<HF |
| C、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| D、碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
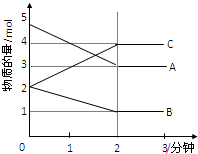 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.
随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.| 物 质 | CO2 | H2 | CH3OH(g) | H2O(g) |
| 起始浓度(mol/L) | 1.0 | 3.0 | 0 | 0 |
| 10min末浓度(mol/L) | 0.75 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 用途或现象 | 体现浓硫酸的性质 |
| (1)浓硫酸使蓝矾变成白色 | |
| (2)浓硫酸使木条变黑 | |
| (3)浓硫酸与铜片共热 | |
| (4)浓硫酸的木炭共热产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中碳原子在同一条直线上 |
| B、光照下能够发生取代反应 |
| C、比丁烷更易液化 |
| D、丙烷有两种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com