
A、用CuCl2溶液做导电性实验时灯泡发光:CuCl2
| ||||
| B、2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O是氧化还原反应 | ||||
| C、HClO中氯元素化合价 比HClO4中氯元素化合价低,所以HClO4的氧化性强 | ||||
D、 将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合液中,生成沉淀与通入CO2的量的关系可以为图所示 |
 ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
| A、在含FeC12杂质的FeCl3溶液中通入足里C12后,充分加热除去过量的C12,即可得到较纯净的FeC13溶液 |
| B、将SO2通入溴水,溴水褪色,说明SO2具有漂白性 |
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、某溶液中加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体,则一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.0L0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32->c(HCO3-)>c(OH-)>c(H+) |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中投入铁粉物质的量是0.25mol |
| B、原溶液中的HNO3浓度是2.0mol/L |
| C、反应后的溶液中还可以溶解9.6g铜 |
| D、反应后的溶液中c(Fe2+):c(Fe3+)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、v(SO2)=4 mol?L-1?min-1 |
| B、v(O2)=3 mol?L-1?min-1 |
| C、v(SO2)=0.1 mol?L-1?s-1 |
| D、v(O2)=0.1 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
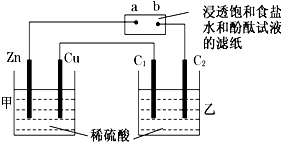
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
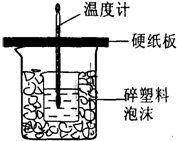 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com