
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝;
②四氧化三铁与盐酸反应生成氯化亚铁、氯化铁;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠.
④Cu与S加热生成Cu2S;
⑤氯化镁与氢氧化钙反应生成氢氧化镁,氢氧化镁分解生成MgO.
解答 解:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成氢氧化铝,故①正确;
②Fe在氧气中燃烧生成四氧化三铁,四氧化三铁与盐酸反应生成氯化亚铁、氯化铁,得不到纯净的氯化铁,氯化铁溶液加热促进水解,得不到氯化铁固体,故②错误;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠,故③正确;
④Cu与S加热生成Cu2S,Cu与S反应不能得到CuS,故④错误;
⑤氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁,故⑤正确.
故选:A.
点评 本题考查了元素化合性质、侯德榜制碱法、盐类水解等,题目难度中等,注意侯德榜制碱法要先通氨气,后通二氧化碳,以便获得高浓度离子溶液.


科目:高中化学 来源: 题型:选择题
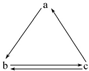 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和NaHCO3溶液的方法收集CO2 | |
| B. | 在H2O2溶液中加入MnO2加快生成O2的速率 | |
| C. | 工业制氨气时,使氨液化从混合气体中分离出来 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与铁粉 | B. | 二氧化碳与石灰水 | ||
| C. | 锌与硫酸 | D. | 碳酸钠与硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NaOH=Na2SO3+H2O | B. | SO2+Cl2+2H2O=H2SO4+2HCl | ||
| C. | SO2+2H2S=3S↓+2H2O | D. | SO2+NO2=SO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com