
【题目】请根据物质的量的相关公式,完成下列问题。(注意书写单位)
(1)3.01×1023个NH3分子的物质的量__。
(2)0.5molH2SO4含有的氧原子的物质的量__。
(3)2.3gNO2的物质的量__。
(4)标况下,33.6LN2的物质的量___。
(5)0.5mol /LK2SO4溶液中,c(K+)=__。
【答案】0.5mol 2mol 0.05mol 1.5mol 1mol/L
【解析】
根据n=![]() =
=![]() =
=![]() 结合物质的构成计算(1)~(4);
结合物质的构成计算(1)~(4);
(5)根据溶液的物质的量浓度与溶质的电离方程式分析解答。
(1)n(NH3)=![]() =0.5mol,故答案为:0.5mol;
=0.5mol,故答案为:0.5mol;
(2)1个H2SO4分子中含有4个O原子,则0.5molH2SO4含有的氧原子的物质的量为0.5mol×4=2mol,故答案为:2mol;
(3)2.3gNO2的物质的量为n(NO2)=![]() =0.05mol,故答案为:0.05mol;
=0.05mol,故答案为:0.05mol;
(4)标况下,33.6LN2的物质的量为n(N2)=![]() =1.5mol,故答案为:1.5mol;
=1.5mol,故答案为:1.5mol;
(5) 0.5mol/L K2SO4中所含的K+的物质的量浓度c(K+)=0.5mol/L×2=1mol/L,故答案为:1mol/L。


科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
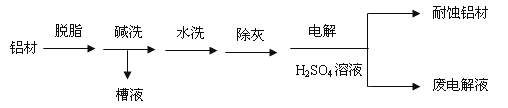
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。

下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。

(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Na2SO4固体来配制480mL0.2mol·L-1的Na2SO4溶液。可供选择的仪器如图:
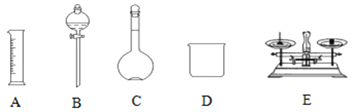
(1)如图所示的仪器中配制溶液不需要的是__ (填选项),配制上述溶液还需用到的玻璃仪器是___、__ (填仪器名称)。
(2)使用容量瓶之前必须进行的操作是___。(填选项)
A.检查气密性 B.检查是否漏水 C.烘干
(3)经计算,需Na2SO4的质量为___g。
(4)你选用的容量瓶规格为___mL。
(5)配制溶液时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其操作顺序:②→__→__→__→__→__→__(填序号)。___
(6)在配制过程中,其他操作都准确,定容时俯视刻度线会使所配溶液浓度__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置 来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________________
②将仪器连接好以后,必须进行的第一步操作是__________
③写出装置C中发生的所有反应的化学方程式______________________________,_______________________________________________________
④D中NaOH溶液的作用__________________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分 数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
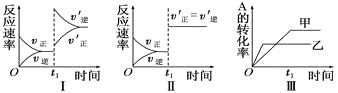
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com