
 印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入.硫磺可用于生产化工原料硫酸.某工厂用如图所示的工艺流程生产硫酸:
印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入.硫磺可用于生产化工原料硫酸.某工厂用如图所示的工艺流程生产硫酸:分析 (1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(2)假设SO2的体积为x,经流量计1通入燃烧室的氧气过量50%,则流量计1中通入氧气的体积为1.5x,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则流量计2中通入氧气的体积为2.5×0.5x=1.25x,据此分析解答;
(3)A.硫铁矿中铁的氧化需要消耗O2;
B.原料选择与SO2的转化率无关;
C.用硫铁矿为原料产生的废渣较多,用硫产生的废渣减少,废气量是相同的;
D.用SO2制取SO3的过程中都需要使用催化剂;
(4)A.橡胶硫化所用到的为单质硫;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C.铅蓄电池中需要用到硫酸和硫酸铅;
D.过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4.
解答 解:(1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增加SO3与浓硫酸的接触面积,有利于SO3的吸收;
(2)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$?_{△}^{催化剂}$2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.4%;SO2为酸性氧化物,可以用碱液(如氨水)吸收,
故答案为:6:5;0.4%;用氨水吸收;
(3)硫铁矿中铁的氧化需要消耗O2,故A项正确;原料选择与SO2的转化率无关,故B项错误;用硫铁矿为原料产生的废渣较多,用硫产生的废渣减少,废气量是相同的,故C项正确;用SO2制取SO3的过程中都需要使用催化剂,D项错误,
故答案为:AC;
(4)橡胶硫化所用到的为单质硫,A项错误;烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,B项正确;铅蓄电池中需要用到硫酸和硫酸铅,C项正确;过磷酸钙的制取过程中需要浓硫酸和磷矿石,D项正确,
故答案为:BCD;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,
所以发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3,2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2),
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3,2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2).
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
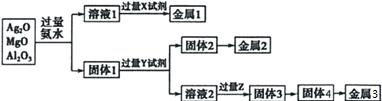
| A. | 可利用淀粉水解产生的X试剂与溶液1反应制金属1 | |
| B. | Y试剂可通过氯碱工业制得 | |
| C. | 过量Z与溶液2的第一步反应是:2OH-+CO2═CO32-+H2O | |
| D. | 工业上用电解固体4法制取金属5,加入冰晶石的作用是降低固体4的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
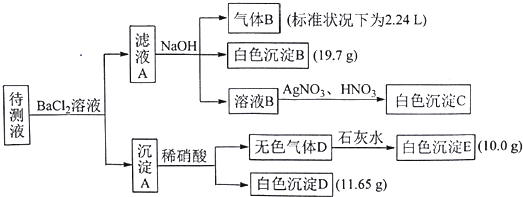
| A. | 向溶液B中加AgNO3与HNO3的操作不是多余的,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-且c(K+)≥0.1mol•L-1 | |
| B. | 生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| C. | 若无色气体D是单一气体,则原溶液中c(SO42-)=0.05 mol•L-1 | |
| D. | 若无色气体D是混合气体,则沉淀A的成分是BaCO3、BaSO3、BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2:7 | B. | 7:15 | C. | 3:8 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在过量氧气中燃烧生成SO3 | |
| B. | 浓硫酸具有吸水性,但不可干燥氨气和二氧化硫 | |
| C. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| D. | 锌与足量稀硫酸反应,滴入几滴硫酸铜溶液,可使反应速率加快,又不影响生成气体的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z单质的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X最高价氧化物对应的水化物,要么是强酸,要么是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用两个铜电极电解CuSO4 溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$ 2Cu↓+O2↑+4H+ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O═4Fe(OH)3+8Na++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
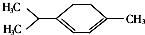 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )| A. | 该有机物的一氯取代物有(不含立体异构)8种 | |
| B. | 该有机物位于同一平面内的碳原子最多有10个 | |
| C. | 该有机物难溶于水,可发生加成、氧化和聚合反应 | |
| D. | 该有机物的最简式为C5H8,与甲苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )
短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | 简单离子半径:D>A>B | |
| C. | 简单氢化物的稳定性:D>C>A | |
| D. | 四种元素的最高价氧化物均可溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com