
 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( )| A.1个N≡N键断裂的同时有6个H-N键形成 |
| B.1个N≡N键断裂的同时有3个H-H键形成 |
| C.容器内各物质的浓度相等 |
| D.容器内N2、H2、NH3的速率之比为1:3:2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
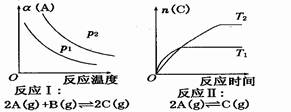
| A.反应Ⅰ:△H>0,p2>p1 | B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅰ:△H<0,p2>p1 | D.反应Ⅱ:△H>0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
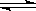 2NO2(g)⊿H = +57KJ/mol,在温度为
2NO2(g)⊿H = +57KJ/mol,在温度为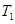 、
、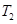 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )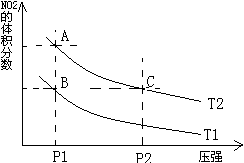
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. 50% | B. 60% | C. 75% | D. 80% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
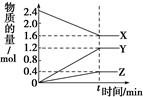
| A.到达t时刻该反应已停止 |
| B.在t时刻之前X的消耗速率大于它的生成速率 |
| C.在t时刻正反应速率等于逆反应速率 |
| D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的物质的量 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1 |
| B.平衡时,N2O4的转化率为60% |
| C.平衡时,体系内NO2为0.04mol·L-1 |
| D.在2s时,体系内压强为反应前的1.1倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。
2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 |
| C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com