
����Ŀ�����ӹ�ҵ��ʹ��![]() ��Һʴ��ͭ������ӡˢ��·�塣�ڸ��Ʊ������У�Ϊ��ʵ����Դ������������Ⱦ��ij��ȤС�������Һ��������Դ���յĹ������£�
��Һʴ��ͭ������ӡˢ��·�塣�ڸ��Ʊ������У�Ϊ��ʵ����Դ������������Ⱦ��ij��ȤС�������Һ��������Դ���յĹ������£�
��.���Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
��.����Һ�м���һ����ʯ��ˮ��������Һ![]() ��ͬʱ���������Ŀ�����
��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]=4��10-38���ش��������⣺
��1��![]() ʴ��ͭ����Ӧ�����ӷ���ʽΪ______��������������м����Ҫ������______
ʴ��ͭ����Ӧ�����ӷ���ʽΪ______��������������м����Ҫ������______
��2���������й��������Ŀ���������Ӧ�Ļ�ѧ����ʽΪ______
��3���������е�����Һ��![]() Ϊ5����������Ũ��Ϊ______������ʽ���㣩
Ϊ5����������Ũ��Ϊ______������ʽ���㣩
��4����һ��ȤС�齫����ӡˢ��·��![]() ʴ��ͭ���ķ�Ӧ��Ƴ�һ��ԭ��ء��뽫������ʵ��װ��ͼ����������������Ӧ��ע������缫���ϡ��������Һ������ѡ���ϣ�
ʴ��ͭ���ķ�Ӧ��Ƴ�һ��ԭ��ء��뽫������ʵ��װ��ͼ����������������Ӧ��ע������缫���ϡ��������Һ������ѡ���ϣ�![]() ��
��![]() ��
��![]() ��
��![]() ��ͭƬ����Ƭ��пƬ��ʯī�͵��ߡ�
��ͭƬ����Ƭ��пƬ��ʯī�͵��ߡ�
��5���Ͼ�ӡˢ��·�徭��������ܵõ��ǽ�����ĩ�ͽ�����ĩ��Ҳ�ɻ�������ʵ����Դ������������Ⱦ��ӡˢ��·��Ľ�����ĩ��![]()
![]() ��
��![]()
![]() �Ļ����Һ�������ܳ�ӡˢ��·�������ĩ�е�ͭ����������������ͬʱ����ò�ͬ����ͭ��ƽ���ܽ����ʣ����±�����
�Ļ����Һ�������ܳ�ӡˢ��·�������ĩ�е�ͭ����������������ͬʱ����ò�ͬ����ͭ��ƽ���ܽ����ʣ����±�����
�¶� | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
ͭƽ���ܽ����� |
|
|
|
|
|
|
|
�����¶ȸ���![]() ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�������Ҫԭ����______��
ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�������Ҫԭ����______��
�����ᴿ���![]() ��Һ�м���һ������
��Һ�м���һ������![]() ��
��![]() ��Һ�����ȣ�����
��Һ�����ȣ�����![]() �������Ʊ�
�������Ʊ�![]() �����ӷ���ʽ��______��
�����ӷ���ʽ��______��
���𰸡�2Fe3++Cu=2Fe2++Cu2+ ���ս���ͭ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4��10-38/10-27=4��10-11 mol/L 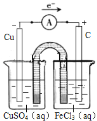 ˫��ˮ�ֽ����ʼӿ� 2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+
˫��ˮ�ֽ����ʼӿ� 2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+
��������
��1�������Ӻ�ͭ����������ԭ��Ӧ���ݴ�д����Ӧ�����ӷ���ʽ����Һ�����������Ӻ�ͭ���ӵȣ�������������м�ѷ�Һ�е�ͭ�����û����������ս���ͭ��
��2�������������ױ������е����������������������ݴ�д����Ӧ�ķ���ʽ��
��3��pH=5��c(H+)=10-5mol/L��c(OH-)=10-9mol/L������Ksp[Fe(OH)3]=c3(OH-)��c(Fe3+)������ֵ���м��㣻
��4��2FeCl3+Cu=2FeCl2+CuCl2���÷�ӦΪ������ԭ��Ӧ��ʯī���������ϣ��Ȼ���������������ԭ��Ӧ��ͭ�ڸ�������������Ӧ���������ҺΪ����ͭ���ݴ����װ��ͼ��
��5�����¶ȹ��ߣ�˫��ˮ�ֽ����ʼӿ���
�����������Ϣд�÷�Ӧ�����ӷ���ʽ��
��1�������Ӻ�ͭ����������ԭ��Ӧ�����ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+����Һ�����������Ӻ�ͭ���ӵȣ�������������м�ѷ�Һ�е�ͭ�����û����������ս���ͭ��
�������������������2Fe3++Cu=2Fe2++Cu2+�����ս���ͭ��
��2����Һ�е�����������OH-��Ӧ�����������������������������ױ������е������������������������Թ������й��������Ŀ���������Ӧ�Ļ�ѧ����ʽ:4Fe(OH)2+O2+2H2O=4Fe(OH)3��
����������������ǣ�4Fe(OH)2+O2+2H2O=4Fe(OH)3��
��3��pH=5��c(H+)=10-5mol/L��c(OH-)=10-9mol/L������Ksp[Fe(OH)3]=c3(OH-)��c(Fe3+)=4��10-38��c(Fe3+)= Ksp[Fe(OH)3]/ c3(OH-)=4��10-38/10-27=4��10-11 mol/L��
����������������ǣ�c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4��10-38/10-27=4��10-11 mol/L ��
��4��2FeCl3+Cu= 2FeCl2+CuCl2,�÷�ӦΪ������ԭ��Ӧ���Ȼ���������ԭ��Ӧ��ͭ����������Ӧ����ˣ�����ͼʾװ�ÿ�֪������ձ���������ͭ��Һ���缫Ϊͭ��ͭ�ڴ˼�����������Ӧ��Cu��2e��=Cu2+ ���������ҺΪ����ͭ���Ҳ��ձ��м����Ȼ�����Һ���缫����Ϊʯī���������ҺΪ�Ȼ������������ڴ˼��õ��ӻ�ԭΪ�������ӣ�����ӦΪ��Fe3++e��=Fe2+����װ��ͼ���£�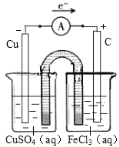 ��
��
����������������ǣ�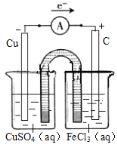 ��
��
��5���ٸ��ݲ�ò�ͬ�¶���ͭ��ƽ���ܽ����ʵ����ݣ��ᷢ�������¶ȵ����ߣ�ͭ��ƽ���ܽ����ʣ����¶ȸ���40��ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�����Ϊ˫��ˮ�����ֽ⣬���½���ͭ�ķ�Ӧ���ʼ�����
�������������������˫��ˮ�ֽ����ʼӿ���
�ڸ��������Ϣ��֪�÷�Ӧ�����ӷ���ʽ����2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+��
��������������ǣ�2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ԭ��Ӧ�ĵ���ת����Ŀ�ͷ���д��������
��1��2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S��+ 3H2O _______������_______
��2��2KMnO4 ��5H2O2 + 3H2SO4 = K2SO4��2MnSO4��5O2�� �� 8H2O _______ ������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A. 25 ��ʱ����0.1 mol��L��1 NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c(Na��)>c(NH)>c(SO![]() )>c(OH��)��c(H��)
)>c(OH��)��c(H��)
B. 25 ��ʱ��NaB��Һ��pH��8��c(Na��)-c(B��)��9.9��10��7 mol��L��1
C. 0.1![]()
![]() ��Һ��
��Һ��![]()
D. ��ͬ���ʵ���Ũ�ȵ�CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������ε��ԭ����ͼ��ʾ���õ����MnSO4��ҺΪ���Һ��̼��ά��Pt/C�ֱ�Ϊ�缫���ϣ���ص��ܷ�ӦΪMn2��+ 2H2O![]() MnO2 + 2H��+ H2��������˵���������
MnO2 + 2H��+ H2��������˵���������
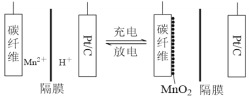
A. ���ʱ��̼��ά�缫������
B. ���ʱ��̼��ά�缫������Һ��pH����
C. �ŵ�ʱ��������Pt/C�缫����������̼��ά�缫
D. �ŵ�ʱ��������ӦʽΪMnO2 + 4H��+ 2e����Mn2��+ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�����̼����![]() ����
����![]() �ֱ�ΪCa2+��Ba2+�������ӣ��ij����ܽ�ƽ��������ͼ��ʾ����֪��
�ֱ�ΪCa2+��Ba2+�������ӣ��ij����ܽ�ƽ��������ͼ��ʾ����֪��![]() ��
��![]() ����֪
����֪![]() ��
��![]() �ܽ�ȸ������������ӵ�ˮ�⣩������˵����ȷ����
�ܽ�ȸ������������ӵ�ˮ�⣩������˵����ȷ����
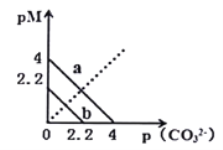
A. ��![]()
![]() ��
��![]() ��Һ�м������
��Һ�м������![]() ��������
��������![]() ���������Ϊ
���������Ϊ![]() ʱ��
ʱ��![]() ǡ�ó�����ȫ������Ũ��Ϊ
ǡ�ó�����ȫ������Ũ��Ϊ![]() ʱ��Ϊ������ȫ��������Һ����仯��
ʱ��Ϊ������ȫ��������Һ����仯��
B. ![]() ��
��![]()
C. ���¶��£���![]() �ı�����Һ�м���
�ı�����Һ�м���![]() ��Һ��һ���ܲ�������
��Һ��һ���ܲ�������
D. ��![]() ��ʾ
��ʾ![]() ���ܽ�ƽ������
���ܽ�ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100 0 mol![]() L��1��NaOH��Һ�ζ�20.00 mLδ֪Ũ�ȵ�ij��HX���ζ�������ͼ��ʾ������˵����ȷ����
L��1��NaOH��Һ�ζ�20.00 mLδ֪Ũ�ȵ�ij��HX���ζ�������ͼ��ʾ������˵����ȷ����

A. �ζ����̿��ü�����ָʾ��
B. �����£�HX�ĵ��볣��ԼΪ1��10��5
C. ��d��Һ�У�c(Na+)��c(X��)��c(OH��)��c(H+)
D. ��b��Һ�У�c(HX) + c(H+)��c(OH��) + c(X��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�ǻ����л�����ԭ�ϣ���A�ϳɸ߷��ӻ�����C��![]() �ĺϳ�·������ͼ�����ַ�Ӧ������ȥ����
�ĺϳ�·������ͼ�����ַ�Ӧ������ȥ����

��֪����R��CN![]() R��COOH
R��COOH
��![]()
�ش��������⣺
(1)A�Ļ�ѧ������____________��
(2)C���������������ŵ�������____________��D�Ľṹ��ʽ��____________��
(3)B![]() C��G
C��G![]() H�ķ�Ӧ���ͷֱ���____________��____________��
H�ķ�Ӧ���ͷֱ���____________��____________��
(4)A![]() E�Ļ�ѧ����ʽ��_________________________________________��
E�Ļ�ѧ����ʽ��_________________________________________��
(5)F![]() G�Ļ�ѧ����ʽ��_________________________________________��
G�Ļ�ѧ����ʽ��_________________________________________��
(6)B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ�Ĺ���________�֣����������칹��������ij��ͬ���칹��M��H2�ӳɵIJ��C5H10O2���ĺ˴Ź���������4��壬�ҷ������Ϊ6��2��1��1����M�Ľṹ��ʽ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴Ӧm A(g)+n B(g) ![]() p C(g) ��H�����ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��t ʱ�¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ���B%�Ĺ�ϵ���ߡ������߷����������ж���ȷ����
p C(g) ��H�����ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��t ʱ�¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ���B%�Ĺ�ϵ���ߡ������߷����������ж���ȷ����

A. T1��T2��P1��P2��m+n��p����H��0
B. T1��T2��P1��P2��m+n��p����H��0
C. T1��T2��P1��P2��m+n��p����H��0
D. T1��T2��P1��P2��m+n��p����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɷ������·�Ӧ��P4+5O2=P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P akJ��mol��1��P��O bkJ��mol��1��P="O" ckJ��mol��1��O="O " dkJ��mol��1��

����ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ����H��������ȷ���ǣ� ��
A. ��6a+5d��4c��12b��kJ��mol��1B��4c+12b��6a��5d��kJ��mol��1 B. ��4c+12b��4a��5d��kJ��mol��1
C. ��4a+5d��4c��12b��kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com