
| A. | 氮气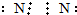 | B. | 氨基H:N:H | ||
| C. | 过氧化氢H+[:O:]2-H+ | D. | 氯化钠Na+[:Cl:]- |
分析 A.氮气分子中存在氮氮三键,应该存在3对共用电子对;
B.氨基为电中性基团,氮原子最外层多画1个电子;
C.过氧化氢是共价化合物,不存在离子键,氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对;
D.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,且阴离子需最外层达到8电子稳定结构.
解答 解:A.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为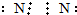 ,故A正确;
,故A正确;
B.氨基为电中性基团,氮原子最外层多画1个电子,氨基电子式为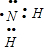 ,故B错误;
,故B错误;
C.过氧化氢是共价化合物,不存在离子键,氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对,电子式为 ,故C错误;
,故C错误;
D.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.


科目:高中化学 来源: 题型:选择题
| A. | 结构简式是CH2CH2 | |
| B. | 使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| C. | 燃烧没有甲烷剧烈 | |
| D. | 性质比较稳定,不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
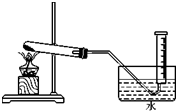 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
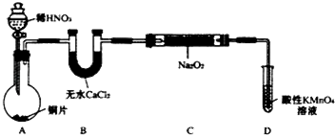
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件可以改变该反应的限度 | |
| B. | 达到平衡后,SO3、SO2、O2在密闭容器中共存 | |
| C. | 达到平衡后,反应停止,正、逆反应速率都等于零 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.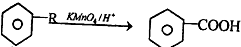
 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com