
已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-<D-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,一定含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚。甲醚是乙醇的同分异构体,其熔点为-141.5 ℃,沸点为-24.9 ℃,在加热条件下可分解成甲烷、乙烷、甲醛等。
(1)乙醇的沸点比甲醚高,其主要原因是________________________________________________________________________。
(2)甲醛分子中碳原子轨道的杂化类型为________________________________________________________________________。
(3)储氢材料化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会缓慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为______________(若含有配位键,要求用箭头表示),1 mol化合物B中σ键的数目是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为 ( )
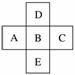
A.5x+10 B.5x
C.5x+14 D.5x+16
查看答案和解析>>
科目:高中化学 来源: 题型:
用“元素符号”填空(前20号元素)
(1)主族序数与周期数相同的元素有________。
(2)主族序数是周期数2倍的元素有________,3倍的元素有________。
(3)周期数是主族序数2倍的元素有________,3倍的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
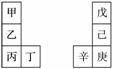
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差11
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
原子结构决定元素的性质,下列说法中正确的是( )
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的一定是无毒的
C.第2周期元素原子的最外层电子数都等于其最高正化合价
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内的物质为杂质),所用的除杂试剂和分离方法都正确的是( )
| A | B | C | D | |
| 被提纯物质 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
| 除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰酸钾溶液 | KI溶液 |
| 分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有___________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有______(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________________,V6=__________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com