
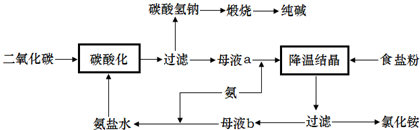
| ||
| ||


科目:高中化学 来源: 题型:
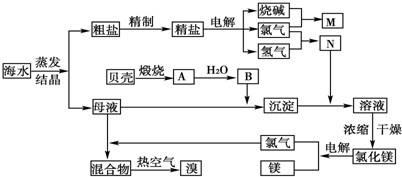
2- 4 |
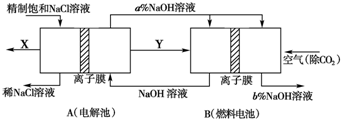
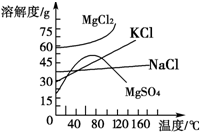
查看答案和解析>>
科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题12 化学与自然资源的开发利用 题型:058
海洋中含有丰富的资源,是人类的巨大宝库.我国拥有很长的海岸线,东部沿岸海滩平缓,多细沙,日照时间长,不少盐场均集中于此.回答下列问题:
(1)制海盐方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,再撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出.请说明盐田获得食盐晶体的条件________.
(2)以食盐为主要原料可以制备纯碱.试用化学方程式表示其制备过程:
________.
此法制得的纯碱中常含有少量氯化钠,要测定样品中的纯碱的质量分数,还可采用下图中的装置进行实验:
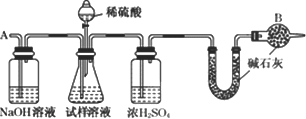
请你用一句话叙述该实验设计的基本原理:________.
(3)氯碱化工厂制得的烧碱中也含有少量氯化钠(假设不含其他杂质),用中和滴定法设计一个实验方案以测定样品中烧碱和氯化钠的质量分数.试剂是0.100 0 mol/L盐酸、酚酞溶液,仪器是50 mL的酸式滴定管、锥形瓶.其实验的主要步骤是________、________、滴定.
(4)工业上用电解法制备金属钠,但制备金属钾一般不采用电解熔融氯化钾,而是采用热还原法来制备.在850℃用金属钠来还原KCl反应如下:
Na(液)+KCl(液)![]() NaCl(液)+K(气).
NaCl(液)+K(气).
工业上应采用哪些措施才能使反应向正反应方向移动?
________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

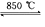 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
(1)、 写出发生氧化还原反应的离子方程式 ;
(2)实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是___________________。
(3)实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为__________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成。
(4)实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
Ⅱ.(5分)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2- 在水溶液中不能大量共存,会发生如下反应: NH4++A102-+H2O=Al(0H)3↓+ NH3↑
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为 ;
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀逐渐减少。请回答各种现象由先到后出现的顺序是(用序号回答): ;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
① ;
② ;
③ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com